Das Flavonoid Procyanidin C1 hat eine senotherapeutische Wirkung und verlängert die Lebensdauer bei Mäusen
Abstrakt
Der altersbedingte funktionelle Rückgang von Organen und das erhöhte Risiko für altersbedingte chronische Pathologien werden teilweise durch die Akkumulation seneszenter Zellen getrieben, die den seneszenzassoziierten sekretorischen Phänotyp (SASP) entwickeln. Hier zeigen wir, dass Procyanidin C1 (PCC1), ein polyphenolischer Bestandteil des Traubenkernextrakts (GSE), durch seine Wirkung auf seneszente Zellen die Gesundheit und Lebensdauer von Mäusen erhöht. Durch das Screening einer Bibliothek von Naturstoffen stellen wir fest, dass GSE und PCC1 als einer seiner aktiven Bestandteile spezifische Wirkungen auf seneszente Zellen haben. Bei niedrigen Konzentrationen scheint PCC1 die SASP-Bildung zu hemmen, während es bei höheren Konzentrationen selektiv alternde Zellen abtötet, möglicherweise durch Förderung der Produktion reaktiver Sauerstoffspezies und mitochondrialer Dysfunktion. Bei Nagetiermodellen, PCC1 erschöpft seneszente Zellen in einer behandlungsgeschädigten Tumormikroumgebung und erhöht die therapeutische Wirksamkeit, wenn es zusammen mit einer Chemotherapie verabreicht wird. Die intermittierende Verabreichung von PCC1 an entweder bestrahlte, seneszente Zellen implantierte oder natürlich gealterte alte Mäuse lindert körperliche Dysfunktion und verlängert das Überleben. Wir identifizieren PCC1 als natürliches senotherapeutisches Mittel mit in-vivo-Aktivität und hohem Potenzial für die Weiterentwicklung als klinische Intervention zur Verzögerung, Linderung oder Vorbeugung altersbedingter Pathologien.
Altern ist einer der größten Risikofaktoren für chronische Erkrankungen, darunter Herz-Kreislauf-Erkrankungen, Stoffwechselstörungen, neurodegenerative Erkrankungen und verschiedene bösartige Erkrankungen, die zusammen den Großteil der Morbidität, Mortalität und Gesundheitskosten weltweit ausmachen1. In den letzten Jahren wurden beträchtliche Fortschritte bei der Entwicklung spezifischer Wirkstoffe zur Behandlung individueller altersbedingter Erkrankungen wie Typ-2-Diabetes, Osteoporose, Knochenbrüchigkeit und Gefäßdysfunktion erzielt. Die kombinierte Wirkung dieser Medikamente bei der Kontrolle von Morbidität und Mortalität chronischer Krankheiten war jedoch bescheiden, und diese Krankheiten treten in der Regel synchron als Multimorbiditäten auf, wobei die Prävalenz nach dem 70. Lebensjahr exponentiell zunimmt2. Mehrere wichtige Faktoren, die die Gesundheit und Lebensdauer beeinflussen, wurden durch Studien an einer Reihe von Arten identifiziert und als Alterungsmechanismen definiert, die in neun Merkmale eingeteilt werden können3. Von diesen grundlegenden Alterungsmechanismen wurde der zellulären Seneszenz große Aufmerksamkeit geschenkt, da sie einen medikamentösen Prozess darstellt, der multiple Alterungskomorbiditäten verhindert oder verzögert4. Erstmals in den 1960er Jahren berichtet, bezieht sich zelluläre Seneszenz auf einen zellulären Zustand, der im Wesentlichen irreversiblen Replikationsstopp, tiefgreifende Chromatinveränderungen, Apoptoseresistenz und erhöhte Proteinsynthese beinhaltet, was häufig in einer Überproduktion von proinflammatorischen Zytokinen gipfelt, einem Merkmal, das als SASP bezeichnet wird und von dem angenommen wird, dass es treiben Alterungsphänotypen und verschiedene altersbedingte Pathologien an5. Ablation seneszenter Zellen positiv für den Seneszenzmarker p16INK4A mildert die Gewebedegeneration und verlängert die Gesundheit der Tiere, was die Behauptung unterstützt, dass seneszente Zellen eine ursächliche Rolle bei der Alterung des Organismus spielen6,7. Der Erfolg in präklinischen Studien hat den Beginn von klinischen Machbarkeitsstudien mit Senolytika für mehrere menschliche Krankheiten mit dem Potenzial zur Verringerung der Belastung alternder Zellen in vivo durch selektive pharmakologische Elimination inspiriert8,9,10. Seit der ersten Entdeckung im Jahr 2015 (Ref. 11) sind mittlerweile eine Handvoll synthetischer oder niedermolekularer Senolytika bekannt. Targeting-Strategien basieren hauptsächlich auf dem Resistenzmechanismus seneszenter Zellen gegenüber Apoptose, der von seneszenzassoziierten anti-apoptotischen Signalwegen abzuhängen scheint, die das Überleben seneszenter Zellen über längere Zeiträume ermöglichen12,13. Die intermittierende Gabe von Senolytika birgt das Potenzial, das Risiko der Entwicklung ungünstiger Erkrankungen bei Patienten zu verringern, unerwünschte Wirkungen von Arzneimitteln zu minimieren und die Entwicklung einer Arzneimittelresistenz von seneszenten Zellen, die sich nicht teilen, zu verhindern, ein Merkmal, das sie von Krebszellen unterscheidet, da Krebszellen erwerben häufig vorteilhafte Mutationen, die eine Resistenz gegen Krebstherapien bieten. Die meisten berichteten Senolytika hängen jedoch von der Zelllinie oder dem Zelltyp ab oder zeigen alternativ eine beträchtliche Zytotoxizität in vivo, wodurch ihre potentielle Verwendung für klinische Zwecke eingeschränkt wird. In dieser Studie haben wir eine aus Anti-Aging-Wirkstoffen bestehende Naturstoff-Arzneimittelbibliothek gescreent und mehrere Kandidaten, darunter GSE, identifiziert. Weitere Analysen ergaben, dass PCC1, ein B-Typ trimerer Epicatechin-Bestandteil von GSE-Flavonoiden, eine wichtige Rolle bei der Hemmung der SASP-Expression bei niedrigen Konzentrationen und bei der Abtötung seneszenter Zellen bei höheren Konzentrationen spielt, letzteres durch Induktion der Apoptose. Präklinische Daten deuten darauf hin, dass PCC1 in Kombination mit einer klassischen Chemotherapie die Tumorgröße signifikant reduzieren und das Überleben in mehreren Mausmodellen verlängern kann. Somit stellt PCC1 eine neue Klasse phytochemischer Senolytika dar, die aus natürlichen Quellen isoliert wurden, die das Altern verzögern und altersbedingte Störungen lindern und eine weitere Erforschung als potenzieller geroprotektiver Wirkstoff in der klinischen Medizin rechtfertigen. Um neue Verbindungen zu identifizieren, die seneszente Zellen effektiv modulieren können, wurde ein unvoreingenommenes Wirkstoff-Screening mit einer phytochemischen Bibliothek durchgeführt, die aus 46 pflanzlichen Arzneimitteln (PDMA-Bibliothek) besteht. Zu diesem Zweck verwendeten wir eine primäre normale menschliche Prostatastromazelllinie, PSC27, als zellbasiertes Modell. PSC27 besteht hauptsächlich aus Fibroblasten, aber mit einem geringen Prozentsatz an Nicht-Fibroblasten-Zelllinien, einschließlich Endothelzellen und glatter Muskelzellen. PSC27 ist per se eine primäre Zelllinie und entwickelt eine typische SASP, nachdem sie Stressfaktoren wie genotoxischer Chemotherapie oder ionisierender Strahlung ausgesetzt wurde14,15,16,17. Wir behandelten diese Zellen mit einer voroptimierten subletalen Dosis Bleomycin (50 μg ml .).-1) und beobachteten eine erhöhte Seneszenz-assoziierte β-Galactosidase (SA-β-Gal)-Färbung, einen verringerten 5-Bromdesoxyuridin-Einbau und erhöhte DNA-Schadensreparatur (DDR)-Foci 7–10 d nach (Ergänzende Abb. 1a – c). Wir haben eine Screening-Strategie entwickelt, um die Auswirkungen einzelner Arzneimittel auf das Überleben und das Expressionsprofil seneszenter Zellen zu vergleichen (Erweiterte Daten Abb. 1a). Ein vielversprechender Vorteil senolytischer Wirkstoffe besteht darin, selektiv den programmierten Tod alternder Zellen zu induzieren, wie ABT-263, ABT-737 und die kombinierte Anwendung von Dasatinib und Quercetin11,18,19. Wir testeten zunächst die Wirksamkeit dieser geroprotektiven Medikamente gegen seneszente PSC27-Zellen, um ihr Potenzial als experimentelles Zellmodell für das Wirkstoff-Screening zu demonstrieren. Unsere vorläufigen Daten legten nahe, dass jede dieser Verbindungen seneszente Zellen, aber keine proliferierenden Zellen signifikant dezimierte, was die Machbarkeit der Verwendung dieser Stromalinie für weitere Studien bestätigt (Erweiterte Daten Abb. 1b). Bei einem groß angelegten Screening der PDMA-Bibliothek identifizierten wir mehrere Verbindungen mit dem Potenzial, seneszente Zellen in Kultur selektiv abzutöten (Erweiterte Daten Abb. 1c-e). Zu den Wirkstoffen, die vorläufige Antiseneszenzwirkungen zeigten, gehörten GSE, Quercetin, Fisetin, Curcumin und Piperlongumin (Erweiterte Daten Abb. 1d, e). Quercetin und Fisetin haben ähnliche chemische Strukturen, üben ähnliche medizinische Wirkungen aus und sind beide bekannte Senolytika11,20,21. Curcumin und Piperlongumin sind ebenfalls natürliche Verbindungen mit kürzlich entdecktem senolytischem Potenzial22,23. Wir entschieden uns, uns auf GSE zu konzentrieren, das eine weitgehend unerforschte Quelle blieb. Unter In-vitro-Bedingungen unterdrückte GSE die SASP mit maximaler Effizienz bei 0,1875 μg ml-1 (Erweiterte Daten Abb. 2a), was zur Eigenschaft der Senomorphie passt24. Niedrigere oder höhere Konzentrationen von GSE waren weniger wirksam, möglicherweise aufgrund der Induktion zellulärer Stressreaktionen als Folge einer erhöhten Zytotoxizität (Erweiterte Daten Abb. 2a). Unter Verwendung von RNA-seq stellten wir fest, dass die Behandlung mit GSE das Expressionsprofil von Seneszenzzellen signifikant veränderte, wobei 2.644 Gene herunterreguliert und 1.472 Gene hochreguliert wurden bei einer Änderung von 2,0 pro Gen (P < 0,01) (Erweiterte Daten Abb. 2b). Obwohl die Expression einiger Gene, die nicht mit der SASP verwandt sind, eine ähnliche Tendenz zeigte wie die typischer SASP-Faktoren (Erweiterte Daten Abb. 2c). 2d, e). In seneszenten Zellen wurde eine nukleäre Translokation von p65, einer der Hauptuntereinheiten des NF-κB-Komplexes, beobachtet, was mit seiner funktionellen Beteiligung an der SASP-Expression übereinstimmt14 (Erweiterte Daten Abb. 2f). Bemerkenswert ist, dass diese Tendenz durch GSE bei niedrigen Konzentrationen (wie 0,1875 μg ml-1). Umgekehrt wurde die Aktivierung der NF-κB-Signalgebung nicht unterdrückt, sondern schien eher verstärkt zu sein, wenn GSE in höheren Konzentrationen (wie 3.7500 μg ml .) verwendet wurde-1), was auf unterschiedliche Reaktionen seneszenter Zellen bei diesen Behandlungsbedingungen hindeutet. Die Aktivierung des DDR-Signalwegs, wie durch die Phosphorylierung der ATM-Kinase in Zellkernfraktionen nachgewiesen wurde, und die Expression des C-X-C-Motiv-Chemokinliganden (CXCL)8, einem der SASP-Markenzeichen, wie in zytoplasmatischen Fraktionen beobachtet, stimmten mit NF . überein -κB Aktivierung in diesen Einstellungen (Erweiterte Daten Abb. 2f). Die Profilerstellung von Protein-Protein-Interaktionen ergab ein hochaktives Netzwerk mit mehreren Faktoren, die bei der zellulären Seneszenz signifikant hochreguliert, aber herunterreguliert wurden, sobald die Zellen GSE ausgesetzt wurden (Erweiterte Daten Abb. 3a). Gen-Ontologie-Profiling ergab, dass diese Moleküle funktionell an biologischen Prozessen beteiligt sind und mit zellulären Komponenten assoziiert sind, die im Allgemeinen mit der sezernierten Natur des SASP übereinstimmen (Erweiterte Daten Abb. 3b,c). Somit ist GSE ein Naturprodukt, das das Potenzial besitzt, das proinflammatorische Profil von seneszenten Zellen, die SASP, zu kontrollieren, wenn es innerhalb eines bestimmten Konzentrationsbereichs verwendet wird. Obwohl GSE in unseren zellbasierten Assays nicht das einzige Naturprodukt mit senolytischer Wirksamkeit war (Erweiterte Daten Abb. 1d, e) konzentrierte sich unsere nachfolgende Studie hauptsächlich auf GSE, da ihre geroprotektive Kapazität besonders auffällig erschien. Angesichts der Wirksamkeit von GSE bei der Reduzierung des SASP als senomorphes Mittel untersuchten wir als nächstes das Potenzial dieses Naturprodukts, seneszente Zellen in höheren Konzentrationen abzutöten, indem es als Senolytikum wirkt. Die SA-β-Gal-Färbung zeigte, dass seneszente Zellen bei einer GSE-Konzentration von 0,75 µg ml . eliminiert wurden-1 (Feige. 1a,b). Bei 3,75 µg ml-1 GSE wurde ein Plateau von 20 % Überlebensrate seneszenter Zellen erreicht (Abb. 1a,b). ein, Quantifizierung des Überlebens von seneszenten PSC27-Zellen durch SA-β-Gal-Positivität. GSE wurde in steigenden Konzentrationen auf das Medium aufgetragen. CTRL, Kontrollzellen (Proliferationszellen); SEN, seneszente Zellen; NS, nicht signifikant. P die Werte wurden durch Einweg-ANOVA mit Tukeys Mehrfachvergleichstest berechnet. B, Repräsentative Bilder, die die SA-β-Gal-Färbung nach der Behandlung von PSC27-Zellen mit unterschiedlichen Konzentrationen von GSE zeigen. Maßstabsleiste, 20 μm. Die Daten sind repräsentativ für drei unabhängige Experimente. DMSO, Dimethylsulfoxid. C, Überlebensanalyse von Kontroll- und seneszenten PSC27-Zellen nach Behandlung mit GSE (bei Konzentrationen von 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 und 15,0000 μg ml-1, bzw). Die Daten sind als Mittelwert ± Standardabweichung angegeben und wurden von drei biologischen Replikaten abgeleitet (n = 3 unabhängige Assays). P Werte wurden durch zweiseitige berechnet T-Tests. D, Zeitverlaufsmessung der In-vitro-Lebensfähigkeit nach Behandlung von Kontroll- und seneszenten PSC27-Zellen mit GSE (3,75 μg ml-1). Die Daten sind als Mittelwert ± Standardabweichung angegeben und wurden von drei biologischen Replikaten abgeleitet (n = 3 unabhängige Experimente). P Werte wurden durch zweiseitige berechnet T-Tests. Und, Durchflusszytometrie-Messung von Kontroll- und seneszenten PSC27-Zellen nach Verarbeitung mit einem Annexin V-FITC und Propidiumiodid (PI)-Kit und 4,6-Diamidino-2-phenylindol (DAPI)-Färbung, um das Ausmaß der Apoptose zu bestimmen. Q1–Q4, Quartile 1–4. F, Vergleichende Quantifizierung des Prozentsatzes der lebensfähigen (Q4, PI−Annexin V−) und apoptotisch (Q2 und Q3, PI+Annexin V+ und PI−Annexin V+) Zellen in Kontrollpopulationen oder seneszenten Populationen, die 3 d lang mit Vehikel oder GSE behandelt wurden (n = 3 biologisch unabhängige Assays). P Werte wurden durch zweiseitige berechnet T-Tests. g, Messung des Fluoreszenzsignals von MitoSOX Red, einem mitochondrialen Superoxidindikator, in PSC27-Zellen unter verschiedenen Bedingungen. P Werte wurden durch zweiseitige berechnet T-Tests. h, Hochauflösende Massenspektren, die das Gesamtionenchromatogramm (TIC) und das Basispeakchromatogramm von GSE nach Durchführung von HPLC-ESI-QTOF-MS zeigen. Sofern nicht anders angegeben, wurden die Zellen 3 d nach der GSE-Behandlung im Kulturzustand relevanten Analysen unterzogen. cps, zählt pro Sekunde. Daten in Balkendiagrammen und Regressionskurven werden als Mittelwert ± Standardabweichung angezeigt und sind repräsentativ für drei biologische Replikate. NS, P > 0,05; *P < 0,05; **P < 0,01; ***P <0,001; ****P <0,0001. Zelllebensfähigkeitsassays zeigten, dass GSE ab einer Konzentration von 0,75 µg ml . den seneszenten Zelltod, aber keinen proliferierten Zelltod induzierte-1 (Feige. 1c). Bei einer Konzentration von 7,50 µg ml-1, ging der Prozentsatz der überlebenden seneszenten Zellen auf etwa 10 % zurück, während die Lebensfähigkeit der proliferierenden Zellen selbst bei 15,00 μg ml . nicht beeinträchtigt war-1 GSE (Abb. 1c), die höchste Konzentration, die in unseren Zellassays verwendet wurde, was auf eine herausragende Selektivität und Spezifität von GSE gegenüber seneszenten Zellen hindeutet, die die Hauptmerkmale von Senolytika sind. Als nächstes haben wir die Fähigkeit von GSE gemessen, seneszente Zellen in einem Zeitverlauf unterschiedlich anzugreifen. Bei Behandlung mit GSE in einer Konzentration von 3,75 µg ml-1, nahm die Lebensfähigkeit seneszenter Zellen erst nach 20 h signifikant ab. Der Unterschied in der Lebensfähigkeit zwischen seneszenten Zellen und der Kontrolle (proliferierende Zellen) erreichte nach 32 Stunden ein Maximum, was auf eine Heterogenität der intrinsischen Resistenz gegenüber Senolytika in seneszenten Zellpopulationen hindeutet (Abb. 1d). Da GSE unterschiedliche Wirkungen gegen seneszente Zellen erzeugt, haben wir die Wirksamkeit von GSE bei der Induktion der Zellapoptose analysiert. Die Durchflusszytometrie zeigte eine signifikant reduzierte Lebensfähigkeit, während die Apoptose von seneszenten Zellen, aber nicht von proliferierenden Zellen, erhöht war (Abb. 1e,f und ergänzende Abb. 2a). Mitochondriale Dysfunktion und metabolische Veränderungen gehören zu den Kennzeichen alternder Zellen und der Alterung des Organismus, Ereignisse, die oxidativen Stress und die Produktion reaktiver Sauerstoffspezies (ROS) wie Superoxid verursachen3,25. Wir haben MitoSOX Red verwendet, einen mitochondrialen Superoxid-Indikator26, um interzelluläre Veränderungen zu untersuchen, und fanden heraus, dass GSE die Bildung von mitochondrialen ROS in seneszenten Zellen förderte, aber nicht in proliferierenden Zellen (Abb. 1g). Somit stimmen unsere Daten mit einem Modell überein, in dem GSE seneszente Zellen durch Induktion von Apoptose und Exazerbation von mitochondrialem Stress in vitro tötet. Traubenkerne machen 38–52 % Trockenmasse der Trauben aus und sind eine reichhaltige Quelle für Antioxidantien27. Wir verwendeten Hochdruckflüssigkeitschromatographie (HPLC) gekoppelt mit Quadrupol-Flugzeit-Massenspektrometrie (QTOF-MS), ausgestattet mit einer Elektrospray-Ionisation (ESI)-Schnittstelle, um die Hauptkomponenten von GSE zu identifizieren. Wir fanden drei Hauptkategorien von sekundären Pflanzenstoffen, darunter Phenolsäuren, Flavonoide (wie Flavan-3-ol, Procyanidine) und andere Verbindungen (Abb. 1h und Zusatztabelle 1). Unter ihnen wurden einige Komponenten als Procyanidine und ihre Derivate identifiziert, von denen berichtet wurde, dass sie auf mitochondriale Proteine abzielen und mehrere chronische Krankheiten lindern28. Die Hauptkomponente(n), die die senolytische Funktion von GSE vermitteln, bleibt jedoch weitgehend unklar. Zu den berichteten biologischen Aktivitäten von Traubenkern-Procyanidinen gehören die Verringerung von oxidativen Schäden, die Unterdrückung von Entzündungen und die Induktion der Apoptose von Krebszellen29,30,31,32. Unter den einzelnen in GSE gefundenen Verbindungen verdient PCC1 besondere Aufmerksamkeit, da gezeigt wurde, dass es DNA-Schäden induziert, den Zellzyklus stoppt und die Expression von Checkpoint-Kinasen erhöht33. Daten aus der vorläufigen Analyse (Gesamtionenchromatogramm) von GSE, einer Mischung aus phytochemischen Wirkstoffen per se, durch HPLC-QTOF-MS deuteten auf das Vorhandensein von PCC1 hin, da das Profil von GSE bei spezifischen MS-Peaks mit dem Chromatogrammprofil von chemisch reinem PCC1 übereinstimmte aus einer kommerziellen Quelle erworben (Abb. 1h und ergänzende Abb. 2b). Es wurde gezeigt, dass PCC1 den BCL-2-Spiegel senkt, jedoch die Expression des Regulators BAX und die Aktivitäten der Caspasen 3 und 9 in kultivierten Krebszellen erhöht, wodurch möglicherweise durch Induktion der Apoptose krebshemmende Wirkungen erzeugt werden33. Daher bewerteten wir als nächstes die Kapazität und Selektivität von PCC1, um seneszente Zellen in Kultur zu eliminieren. Die Daten legen nahe, dass PCC1 für seneszente Stromazellen ab einer Konzentration von 50 μM senolytisch ist, bei der proliferierende Zellen weitgehend unbeeinflusst bleiben (Abb. 2a,b und Zusatztabelle 2). Obwohl höhere Konzentrationen eine geringere Überlebensrate von seneszenten Zellen verursachten, mit einem Schwellenwert von ungefähr 200 μM, zeigte PCC1 nur bei einer Verwendung von 600 μM oder höher Toxizität gegenüber Kontrollzellen (Abb. 2b). Ein zeitlicher Verlauf der Caspase 3/7-Aktivität zeigte, dass PCC1 innerhalb von 12 Stunden apoptotische Effekte ausübte und nach 24 Stunden ein Plateau erreichte (Abb. 2c). Dieses Ergebnis stimmte weitgehend mit den Lebensfähigkeitsmessungen überein (Abb. 2d). Die senolytische Natur von PCC1 wurde durch Zellen bestätigt, die aufgrund von replikativer Erschöpfung oder Seneszenz (RS) oder Onkogen (HRAS .) in die Seneszenz eingetreten sindG12V) Überexpression (OIS), die stressige Insults ähnlich denen der therapieinduzierten Seneszenz erzeugt (Abb. 2e, Erweiterte Daten Abb. 4b – e und Zusatztabelle 2). Zusammengenommen legen die Ergebnisse nahe, dass PCC1 seneszente menschliche Stromazellen, die durch verschiedene Stimuli induziert wurden, dosisabhängig selektiv beseitigt, jedoch ohne signifikante Wirkung auf nichtseneszente Zellen, wenn es in geeigneten Konzentrationen verwendet wird. ein, Messung des Überlebens von seneszenten PSC27-Zellen durch SA-β-Gal-Färbung. PCC1 wurde in steigenden Konzentrationen appliziert. P die Werte wurden durch Einweg-ANOVA mit Tukeys Mehrfachvergleichstest berechnet. B, Überleben von seneszenten PSC27-Zellen, induziert durch Bleomycin bei steigenden PCC1-Konzentrationen. C, Apoptotischer Assay für Caspase 3/7-Aktivität. D, Zeitverlaufs-Überlebenskurven zur Beurteilung der Lebensfähigkeit der PSC27-Zellen nach der PCC1-Behandlung. Und, Bilder der SA-β-Gal-Färbung. TIS, therapieinduzierte Seneszenz (durch Bleomycin). Maßstabsleiste, 20 μm. Die Daten sind repräsentativ für drei unabhängige Experimente. F, Durchflusszytometrie nach Verarbeitung mit einem Annexin V-FITC- und PI-Kit und DAPI-Färbung zur Bestimmung des Apoptosespiegels. g, Quantifizierung des Prozentsatzes der lebensfähigen (Q4, PI−Annexin V−) und apoptotisch (Q2 und Q3, PI+Annexin V+ und PI−Annexin V+) Zellen nach Behandlung mit Vehikel oder PCC1 für 3 d (n = 3 biologisch unabhängige Assays). h, Immunfluoreszenzfärbung von PSC27-Zellen. RS wurde durch serielles Passieren vor der PCC1-Behandlung induziert. Rot, p16TINTE4a. Zellen bei einer frühen Passage (P10) wurden als negative Kontrolle verwendet. Als Positivkontrolle wurde ABT-263 (1,25 µM) getestet. Maßstabsleiste, 20 μm. ich, Statistik der Immunfluoreszenz-Färbung. J, PCC1-induzierte senolytische Aktivität nach Pan-Caspase-Hemmung (20 μM QVD-OPh). zu, PD-Assay von menschlichen MSCs. PCC1 wurde am 8. Tag nach Versuchsbeginn wie angegeben appliziert. BLEO, Bleomycin. Für C,D,zu, Daten sind als Mittelwert ± Standardabweichung dargestellt und wurden von drei biologischen Replikaten abgeleitet (n = 3 unabhängige Assays). Für Daten in B-D,g,ich,J, P Werte wurden durch zweiseitige berechnet T-Tests. In Experimenten für C-zu, PCC1 wurde bei 100 &mgr;M verwendet. Sofern nicht anders angegeben, wurden 3 Tage nach der PCC1-Behandlung Proben für Analysen entnommen. Daten in Balkendiagrammen werden als Mittelwert ± Standardabweichung angezeigt und sind repräsentativ für drei biologische Replikate. NS, P > 0,05; *P < 0,05; **P < 0,01; ***P <0,001; ****P <0,0001. Um die Wirksamkeit von PCC1 über Zelllinien experimentell zu erweitern und zu etablieren, behandelten wir humane fetale Lungenfibroblasten (WI38), primäre humane Nabelvenen-Endothelzellen (HUVECs) und humane mesenchymale Stammzellen (MSCs) mit PCC1 und fanden heraus, dass seneszente Zellen all dieser Linien ähnliche Anfälligkeit für selektive Ablation durch PCC1, während ihre nicht seneszenten Gegenstücke lebensfähig blieben (Erweiterte Daten Abb. 4f–h und Zusatztabelle 3). Wir bestätigten ferner die Induktion der Apoptose in seneszenten Zellen als Reaktion auf PCC1 durch Durchflusszytometrie, während proliferierende Zellen von PCC1 weitgehend unbeeinflusst blieben (Abb. 2f,g). Zusammenfassend zeigen unsere Daten, dass PCC1 seneszente Zellen über verschiedene Zelltypen hinweg selektiv eliminiert und auf verschiedene Auslöser der Seneszenz zurückzuführen ist. Um die Depletion seneszenter Zellen durch PCC1 zu visualisieren, untersuchten wir die Expression von p16TINTE4a, ein weit verbreiteter Seneszenzmarker, in Stromazellen, bei denen RS aufgetreten ist. PCC1 entfernte effektiv p16-positive seneszente Zellen, die nur in PSC27-Populationen mit später Passage auftraten, mit einer Wirksamkeit, die der von ABT-263 (1,25 μM), einem gut etablierten synthetischen Senolytikum, weitgehend ähnelte18,21 (Feige. 2h, ich). Um zu belegen, dass die PCC1-vermittelte Elimination seneszenter Zellen hauptsächlich durch Induktion der Apoptose und nicht durch andere Formen des programmierten Zelltods erfolgt, behandelten wir Zellen mit dem Pan-Caspase-Apoptose-Inhibitor Chinolyl-valyl-DAS-Methylaspartyl-(-2,6-difluorphenoxy)-methylketon (QVD-OPh). Die Fähigkeit von PCC1, seneszente Zellen abzutöten, wurde durch QVD-OPh umgekehrt. PCC1 teilt somit seine Caspase-abhängige Induktion der Apoptose als senolytisches Merkmal mit ABT-263 (Abb. 2j). Weitere Analysen mit chemischen Inhibitoren schlossen PCC1-induzierten Zelltod durch Ferroptose, Pyroptose oder Nekroptose aus (Erweiterte Daten Abb. 4i). Um das Potenzial einer Verdoppelung der Zellpopulation (PD) nach einer Behandlung mit genotoxischen Medikamenten zu bewerten, haben wir MSCs eingesetzt, die sich selbst erneuern und die koloniebasierte Proliferation selbst nach Exposition gegenüber Umweltstress wieder aufnehmen können34, wahrscheinlich aufgrund der Heterogenität des Schadens, wobei Zellen weniger Schaden erleiden, vermutlich in der Lage sind, das Potenzial zur Selbsterholung und zum Wiedereintritt in den Zellzyklus zu behalten24,35. Im Gegensatz zu Bleomycin-geschädigten Zellen, die nach der Behandlung schnell in einen Wachstumsstillstand eintraten, verbesserte die Post-Seneszenz-Behandlung mit PCC1 die PD-Kapazität von MSCs signifikant, insbesondere nach der Entfernung von seneszenten Zellen, die das SASP entwickeln und das Potenzial haben, parakrine Seneszenz innerhalb von Zellpopulationen zu induzieren (Abb . 2k). Die Behandlung mit PCC1 beeinflusste jedoch nicht die PD von proliferierenden Zellen, was ein weiteres Indiz für die Selektivität von PCC1 für seneszente Zellen im Vergleich zu ihren normalen Gegenstücken ist. Da GSE ein komplexes phytochemisches Gemisch ist, von dem viele seiner Bestandteile antioxidative und entzündungshemmende Wirkungen haben27,36untersuchten wir, ob PCC1 der Hauptbestandteil von GSE ist, der an der Depletion alternder Zellen beteiligt ist, oder ob alternative sekundäre Pflanzenstoffe in GSE zu seiner senolytischen Gesamtwirkung beitragen könnten. Dazu untersuchten wir den Einfluss einzelner phytochemischer Moleküle auf das Überleben seneszenter PSC27-Zellen. Die meisten GSE-Komponenten zeigten im Dosisbereich von PCC1 keine senolytische Aktivität und verursachten keinen signifikanten Tod proliferierender Zellen (Ergänzende Abb. 3 und 4). Obwohl das Flavonoid Quercetin wie in unseren vorherigen Studien eine senolytische Aktivität zeigte, eine Eigenschaft, die mit natürlichen Flavonen geteilt wird11,21, „rekonstituiertes GSE“, bestehend aus den Hauptkomponenten, die gemäß ihrem Massenprozentsatz gemischt werden, wie aus unseren HPLC-QTOF-MS-Daten hervorgeht (Ergänzungstabelle 1, beachten Sie, dass Quercetin nur 0,9% ausmacht), aber der bewusste Ausschluss von PCC1 zeigte keine ähnlichen Ergebnisse wie die für PCC1 in beiden Assays beobachteten (Ergänzende Abb. 3 und 4). Obwohl wir nicht schließen können, ob andere Komponenten einen Beitrag leisten, legen unsere Daten eindeutig nahe, dass PCC1 ein primärer Mediator der senolytischen Wirkung von GSE ist. Angesichts der herausragenden Wirksamkeit von PCC1 bei der selektiven Induktion des seneszenten Zelltods haben wir die zugrunde liegenden Mechanismen untersucht. PCC1 gehört zur Superfamilie der Flavonoide, die freie Radikale abfangen, Metalle chelatisieren und die Hydroperoxidbildung reduzieren können27. Die antioxidative Kapazität von Procyanidinen wird teilweise durch ihren Polymerisationsgrad bestimmt, während PCC1 von Natur aus ein Procyanidin-Epicatechin-Trimer ist (Abb. 3a). ein, Chemische Struktur des trimeren Epicatechins PCC1. B, Heatmap, die Top-Gene (50) zeigt, die in seneszenten PSC27-Zellen signifikant hochreguliert sind, jedoch nach PCC1-Behandlung (50 μM) herunterreguliert werden. Rote Sterne, SASP-Faktoren. C, GSEA-Plot eines signifikanten Gensatzes im SASP-Spektrum. FDR, Rate falscher Entdeckungen; NES, normalisierter Anreicherungswert. D, GSEA-Diagramm eines signifikanten Gensatzes, der mit NF-&kgr;B-vermittelter Signalgebung assoziiert ist. Und, NetworkAnalyst-Karte von Protein-Protein-Wechselwirkungen typischer SASP-assoziierter Faktoren, die in seneszenten Zellen signifikant hochreguliert, aber durch PCC1-Behandlung herunterreguliert werden. F, Heatmap, die die unterschiedliche Expression von Genen der BCL-2-Familie in Kontroll-, seneszenten und PCC1-behandelten seneszenten Zellen zeigt. g, Immunblot von PSC27-Zellen, die verschiedenen Mitteln ausgesetzt wurden. Die Expression von pro-apoptotischen und anti-apoptotischen Faktoren und DDR-Signal-assoziierten Molekülen wurde untersucht. Caspase 3 (t), Gesamtcaspase 3; Caspase 3 (c), gespaltene Caspase 3; p, phosphoryliert. β-Actin und GAPDH, Ladekontrollen. Die Daten sind repräsentativ für drei unabhängige Experimente. h, Zellen wurden mit drei verschiedenen RNA-Spezies mit kurzen Haarnadeln infiziert, die darauf abzielen VERLETZUNG oder PUMA bevor sie Bleomycin ausgesetzt wurden, um die Seneszenz zu induzieren. Sieben Tage später wurden die Zellen mit PCC1 (100 &mgr;M) über einen Zeitraum von 3 Tagen behandelt, um Apoptose zu induzieren. SCR, Scramble. ich, VERLETZUNG Expression wurde mittels quantitativer PCR mit reverser Transkription (RT–qPCR) bestimmt. Die Zellen wurden mit Bleomycin behandelt, um eine Seneszenz zu induzieren, bevor sie 3 d lang 100 μM PCC1 in Abwesenheit oder Anwesenheit von 10 μM MK2206, 10 μM Ruxolitinib oder 20 nM BMS-582949 ausgesetzt wurden, um die Aktivität von AKT, JAK1 und/oder JAK2 oder p38 . zu hemmen MAPK bzw. J, Ein ähnlicher Satz von RT-qPCR-Expressionsassays für PUMA unter Verwendung der in beschriebenen Bedingungen ich. zu-m, Messung der Zelllebensfähigkeit nach PCC1-Behandlung in Abwesenheit oder Anwesenheit von MK2206 (zu), Ruxolitinib (L) oder BMS-582949 (m), enthalten, um die enzymatische Aktivität von AKT, JAK1 und/oder JAK2 bzw. p38 MAPK zu hemmen. Für Daten in C,D, P die Werte wurden durch Einweg-ANOVA mit Tukeys Post-hoc-Vergleich berechnet. Statistische Signifikanz in h-m wurde mit zweiseitigen berechnet T-Tests oder Einweg-ANOVA (Dunnett-Test). Die Daten in allen Balkendiagrammen werden als Mittelwert ± Standardabweichung angezeigt und repräsentieren drei biologische Replikate. NS, P > 0,05; *P < 0,05; **P < 0,01; ***P <0,001; ****P <0,0001. Wir analysierten zunächst den Einfluss von PCC1 auf die transkriptomweite Expression seneszenter Zellen. Die Bioinformatik zeigte, dass in Stromazellen nach PCC1-Behandlung 4.406 Gene signifikant hochreguliert und 2.766 Gene herunterreguliert wurden (Ergänzende Abb. 5a). Wir beobachteten eine Vielzahl von SASP-Faktoren, deren Expression während der zellulären Seneszenz deutlich hochreguliert war, aber im Wesentlichen herunterreguliert wurde, wenn seneszente Zellen PCC1 ausgesetzt wurden (Abb. 3b). Das GSEA-Profiling zeigte, dass sowohl die SASP- als auch die NF-κB-Signaturen durch die PCC1-Behandlung bemerkenswert unterdrückt wurden (Abb. 3c,d). Wir stellten außerdem fest, dass mehrere gegenseitige Interaktionen oder funktionelle Verbindungen zwischen diesen Faktoren, die während der Seneszenz hochreguliert und nach der PCC1-Behandlung herunterreguliert wurden, in der Liste der am häufigsten differenziell exprimierten Gene auftauchen, von denen die meisten typischerweise sezernierte Faktoren waren (Abb. 3e). Um die Selektivität von PCC1 für seneszente Zellen zu verstehen, haben wir das transkriptomische Expressionsprofil weiter untersucht und festgestellt, dass PCC1 Expressionsänderungen bei einigen Mitgliedern der BCL-2-Superfamilie induzierte (Abb. 3f). Obwohl die DDR-Signalgebung weitgehend unbeeinflusst blieb, wurde eine PCC1-abhängige Hochregulierung oder Aktivierung der p38-Mitogen-aktivierten Proteinkinase (MAPK) beobachtet, wobei in diesen Zellen eine Spaltung von Caspase 3 stattfand (Abb. 3g). Obwohl die BCL-xL-Expression in seneszenten Zellen im Vergleich zu ihren proliferierenden Kontrollen erhöht war, erhöhte die PCC1-Behandlung den Proteinspiegel nicht weiter. Die Werte der anderen beiden BCL-2-Faktoren, nämlich BCL-2 und BAX, blieben weitgehend unverändert. Während NOXA und PUMA (zwei Mitglieder der pro-apoptotischen Subfamilie der BCL-2 Homologiedomäne 3 (BH3)) unterschiedliche Expressionsmuster während der zellulären Seneszenz zeigten, führte die PCC1-Behandlung zu einer Hochregulierung beider Faktoren (Abb. 3g). Der Abbau von pro-apoptotischen BCL-2-Faktoren deutete darauf hin, dass NOXA und PUMA teilweise die senolytischen Wirkungen von PCC1 vermittelten (Abb. 3h und erweiterte Daten Abb. 5a–c). Die Behandlung mit chemischen Inhibitoren der AKT-Kinase-, Janus-Kinase (JAK)1-1, JAK2- und p38-MAPK-Signalgebung deutete auch auf eine Beteiligung dieser Signalwege bei der Expression von PMAIP1 (VERLETZUNG) und BBC3 (PUMA) und Apoptose seneszenter Zellen nach PCC1-Behandlung (Abb. 3i–m). Als niederschlagen VERLETZUNG und PUMA hemmte die senolytische Wirkung von PCC1 nur teilweise (Abb. 3h, k – m) haben wir andere mögliche Mechanismen untersucht, die zum Tod von seneszenten Zellen führen. Da Procyanidine normalerweise die Lebensfähigkeit der Zellen erhöhen, die ROS-Produktion verringern und oxidativen Stress in Säugerzellen hemmen37,38, fragten wir als nächstes, ob ähnliche oder antioxidative Wirkungen in seneszenten Zellen, die PCC1 ausgesetzt waren, beobachtet werden könnten. Überraschenderweise fanden wir, dass das Gegenteil der Fall war, da seneszente PSC27-Zellen bei Behandlung mit PCC1 im Gegensatz zu ihren proliferierenden Gegenstücken erhöhte ROS-Werte aufwiesen (Abb. 4a und erweiterte Daten Abb. 5d, Signale der 2′-7′-Dichlordihydrofluoresceindiacetat (DCFH-DA)-Sonde beachten). Behandlung mit HS-1793, einem stabilen Resveratrol-Analogon, das freie Radikale abfängt39, blockierte effektiv die ROS-Produktion in seneszenten Zellen, die mit PCC1 behandelt wurden (Erweiterte Daten Abb. 5e,f), während die ROS-Spiegel weiter erhöht wurden, nachdem PCC1-behandelte seneszente Zellen CCCP, einem protonophoren mitochondrialen Entkoppler, ausgesetzt wurden40, oder Ruxotemitid (LTX-315), ein amphipathisches kationisches Peptid, das die Permeabilisierung der äußeren mitochondrialen Membran induziert41, die jeweils in Konzentrationen angewendet wurden, die für Kontrollzellen nicht zytotoxisch waren (Erweiterte Daten Abb. 5e,f). Obwohl die Behandlung mit CCCP oder Ruxotemitid per se ebenfalls eine erhöhte ROS-Produktion verursachte, waren die Wirkungen im Allgemeinen geringer als die durch PCC1 induzierten, was darauf hindeutet, dass PCC1 eine mitochondriale Dysfunktion in seneszenten Zellen auslöst. Durch Messung des apoptotischen Index von seneszenten Zellen (Caspase 3/7-Aktivität) fanden wir, dass die PCC1-induzierte Wirkung bei Kombination von PCC1 mit jedem mitochondrialen Disruptor weiter verstärkt, aber bei gleichzeitiger Behandlung mit HS-1793 unterdrückt werden konnte (Erweiterte Daten Abb . 5g). ein, Messung von ROS-Spiegeln mit DCFH-DA, einer zelldurchlässigen Fluoreszenzsonde, die empfindlich auf Veränderungen im zellulären Redoxzustand reagiert. Die Experimente wurden 1 Tag nach der PCC1-Behandlung durchgeführt. Links, repräsentative Bilder. Maßstabsleiste, 10 μm. Richtig, Statistik. DCF, Dichlordihydrofluorescein. B, Immunblot, nachdem Zellen verschiedenen Behandlungen ausgesetzt wurden. Die Cytochrom-c-Verteilung zwischen Mitochondrien und dem Zytoplasma wurde profiliert, indem Mitochondrien aus Zytosolüberständen 3 Tage nach der PCC1-Behandlung isoliert wurden. COX IV ist das terminale Enzym der mitochondrialen Atmungskette und ein mitochondrialer Marker. C, Zeitverlaufs-Überlebenskurven zur Beurteilung der Lebensfähigkeit von PSC27-Zellen nach Behandlung mit PCB2, einem anderen Mitglied der natürlichen Procyanidin-Familie. Die Daten sind als Mittelwert ± Standardabweichung angegeben und wurden von drei biologischen Replikaten abgeleitet (n = 3 unabhängige Assays). D, ROS-Produktionsassay auf ähnliche Weise wie in beschrieben durchgeführt ein, außer dass die Zellen PCB2 ausgesetzt waren. Maßstabsleiste, 10 μm. Und, Immunblot der Expression und Verteilung von ATM, p53 und Caspase 3 zwischen Zytoplasma und Zellkern. GAPDH und Lamin A/C, Ladekontrollen für Zytoplasma bzw. Kerne. C1, PCC1; B2, PCB2. F, Konfokalmikroskopie der Immunfluoreszenzfärbung nach Behandlung von Zellen mit Vehikel (DMSO) oder PCC1. Es wurden primäre Antikörper, die spezifisch für p53 oder COX IV waren, verwendet. Maßstabsleiste, 10 μm. g, Immunblot-Analyse von PSC27-Zellen, die verschiedenen Mitteln ausgesetzt waren. Zyto, Zytoplasma; mito, mitochondrial. h, Analyse der JC-1-Färbung, eine fluoreszierende Sonde, die m anzeigt. Die Signale wurden über 3 d gemessen. Grüne Fluoreszenz weist auf JC-1-Monomere hin (sie erscheinen im Zytosol nach Depolarisation der mitochondrialen Membran und weisen auf Apoptose im Frühstadium hin). Rote Fluoreszenz zeigt JC-1-Aggregation (befindet sich auf intakten Mitochondrien). Links, repräsentative Bilder. Richtig, Statistik. Sowohl PCC1 als auch PCB2 wurden in relevanten Assays mit 100 μM verwendet. Daten in B,Und-g sind repräsentativ für drei unabhängige Experimente. Statistische Signifikanz in ein (Rechts), D (richtig und h (rechts) wurde mit zweiseitigen . berechnet T-Tests, und das in C wurde mit Einweg-ANOVA (Dunnett-Test) berechnet. Die Daten in allen Balkendiagrammen werden als Mittelwert ± Standardabweichung angezeigt und sind repräsentativ für drei biologische Replikate. NS, P > 0,05; *P < 0,05; **P <0,01. Die Freisetzung von Cytochrom c und die Zerstörung der mitochondrialen Membran sind intrazelluläre Ereignisse, die mit der Apoptose verbunden sind und oft als direkte apoptotische Triebkräfte wirken42. Unsere Daten legen nahe, dass die PCC1-Behandlung die Cytochrom-C-Freisetzung aus den Mitochondrien in den umgebenden zytoplasmatischen Raum verstärkt (Abb. 4b und erweiterte Daten Abb. 5h). Die Freisetzung von Cytochrom c aus Mitochondrien stimmt weitgehend mit biochemischen Reaktionen wie der Caspase-Aktivierung in PCC1-behandelten seneszenten Zellen überein (Abb. 3g). Mitglieder der Procyanidin-Familie weisen ein breites Spektrum pharmakologischer Eigenschaften auf, einschließlich Antioxidation und Entzündungshemmung, die das Gegenteil von dem sind, was wir bei der Behandlung seneszenter Zellen mit PCC1 beobachtet haben. Die aktuellen Daten veranlassten uns zu überlegen, ob die Wirkungen von PCC1 durch andere Procyanidine reproduziert werden. Procyanidin B2 (PCB2) ist ein repräsentatives Flavonoid, das als Dimer vorliegt und den ROS-Spiegel bei oxidativem Stress in kultivierten Zellen senkt43. PCB2 konnte seneszente Zellen nicht eliminieren (Abb. 4c und ergänzende Abb. 3b und 4b) und weder verstärkte ROS-Produktion noch induzierte mitochondriale Freisetzung von Cytochrom c in seneszenten Zellen (Abb. 4d und erweiterte Daten Abb. 5i). Eine beträchtliche Menge von p65 (RelA), einer der Hauptuntereinheiten des NF-κB-Komplexes, transloziert in den Kern seneszenter Zellen (Abb. 4e). Obwohl die Behandlung mit PCB2 der nuklearen Translokation von p65 entgegenwirkte, was mit seiner entzündungshemmenden Kapazität übereinstimmt, wurde dieser Effekt von PCC1 nicht reproduziert (Abb. 4e). Seneszente Zellen, die PCC1 ausgesetzt waren, zeigten eine bemerkenswerte Caspase-3-Spaltung, während diejenigen, die mit PCB2 behandelt wurden, dies nicht taten, was die biologische Aktivität dieser beiden Procyanidin-Moleküle weiter unterschied (Abb. 4e). Als ein Faktor, der das Zellschicksal funktionell steuert, kann p53 Apoptose entweder durch die Transaktivierung pro-apoptotischer Gene oder transkriptionsunabhängig durch Translokation in Mitochondrien induzieren44. Wir beobachteten eine erhöhte Kerntranslokation von p53 nach zellulärer Seneszenz, ein Muster, das von PCC1 deutlich reduziert wurde, aber viel weniger als das von PCB2 (Abb. 4e, f). Da der Kernausschluss von p53 ein kritischer Schritt bei der Induktion der Apoptose seneszenter Zellen ist45, haben wir die Verteilung von p53 weiter untersucht. Immunfluoreszenzfärbung zeigte eine deutlich erhöhte Überlappung von p53 mit der Cytochrom-c-Oxidase-Untereinheit IV (COX IV) (ein Transmembranproteinkomplex in der mitochondrialen respiratorischen Elektronenkette, der oft als mitochondrialer residenter Proteinmarker verwendet wird) in PCC1-behandelten seneszenten Zellen, was auf eine verstärkte Translokation von . hinweist p53 in die mitochondriale Matrix. Obwohl wir etwas p53 in Mitochondrien von proliferierenden Zellen beobachteten, induzierte PCC1 keinen bemerkenswerten oder umfassenden Einstrom von p53-Protein in die mitochondriale Matrix proliferierender Zellen (Abb. 4f). In seneszenten Zellen waren die p53-Spiegel jedoch in den Zellkernen erniedrigt, in den Mitochondrien jedoch nach Exposition gegenüber PCC1 erhöht (Abb. 4g). Der Rückgang des mitochondrialen Membranpotentials (Δψm) ist ein Ereignis, das Apoptose über den mitochondrial vermittelten intrinsischen Signalweg auslösen kann46. Wir fanden, dass Δψm in seneszenten Zellen signifikant reduziert war, während proliferierende Zellen in Gegenwart von PCC1 im Wesentlichen unbeeinflusst blieben, wie das Profil der JC-1-Sondensignale zeigt (Abb. 4h). Somit fördert PCC1 die ROS-Erzeugung, löst die Cytochrom-C-Freisetzung aus und verursacht m-Störungen in seneszenten Zellen, Ereignisse, die von Natur aus mit mitochondrialer Behinderung verbunden sind und die Zellapoptose funktionell vorantreiben. Zusammengenommen legen unsere experimentellen Daten nahe, dass seneszente Zellen einer PCC1-induzierten Apoptose unterliegen, einem Prozess, der teilweise durch VERLETZUNG und PUMA Hochregulierung und verbunden mit einer erhöhten ROS-Produktion und einer mitochondrialen Dysfunktion. Angesichts der Fähigkeit und Selektivität von PCC1 zur Eliminierung seneszenter Zellen in vitro untersuchten wir als nächstes, ob dieses Mittel genutzt werden könnte, um gegen altersbedingte Pathologien in vivo einzugreifen. In der klinischen Onkologie schränkt die Arzneimittelresistenz die Wirksamkeit der meisten Krebsbehandlungen ein, während seneszente Zellen häufig durch die Entwicklung einer in vivo-SASP in der arzneimittelgeschädigten Tumormikroumgebung (TME) zur therapeutischen Resistenz beitragen.15,16,47. Die pharmakologische Eliminierung von therapieinduzierten seneszenten Zellen minimiert Nebenwirkungen der Chemotherapie und verhindert das Wiederauftreten von Krebs bei Tieren48. Die Möglichkeit einer PCC1-vermittelten Depletion von seneszenten Zellen aus Primärtumoren zur Steigerung der Wirksamkeit von Krebsbehandlungen bleibt jedoch weitgehend unbekannt. Erstens haben wir uns für den Aufbau von Geweberekombinanten entschieden, indem wir PSC27-Zellen mit PC3-Zellen, die eine typische Prostatakrebszelllinie mit hoher Malignität sind, in einem voroptimierten Verhältnis (1:4) vermischt haben.14. Die Zellen wurden dann subkutan in die Hinterflanke von Mäusen mit nicht adipösem Diabetes und schwerer kombinierter Immunschwäche (NOD-SCID) implantiert. Die Tumoren der Tiere wurden am Ende eines 8-wöchigen Zeitraums gemessen und Gewebe zur pathologischen Bewertung entnommen. Im Vergleich zu Tumoren, die PC3-Krebszellen und naive PSC27-Stromazellen umfassten, zeigten Xenotransplantate aus PC3-Zellen und seneszenten PSC27-Zellen ein signifikant erhöhtes Volumen, was die tumorwachstumsfördernde Wirkung seneszenter Zellen bestätigt (Erweiterte Daten Abb. 6a). Um klinische Zustände nachzuahmen, haben wir experimentell ein präklinisches Regime entwickelt, das genotoxische Therapeutika und/oder Senolytika enthält (Abb. 5a). Zwei Wochen nach der subkutanen Implantation, als eine stabile Aufnahme von Tumoren in vivo beobachtet wurde, wurde den Tieren am 1. Tag der 3., 5. und 7. Woche bis zum Ende des das 8-Wochen-Schema (Erweiterte Daten Abb. 6b). Im Gegensatz zur Placebo-behandelten Gruppe verzögerte die MIT-Verabreichung das Tumorwachstum bemerkenswert, was die Wirksamkeit von MIT als Chemotherapeutikum bestätigte (44,0 % Reduktion der Tumorgröße) (Abb. 5b). Obwohl die Verabreichung von PCC1 selbst keine Tumorschrumpfung verursachte, verbesserte die Behandlung mit MIT gefolgt von einer PCC1-Verabreichung (20 mg pro kg über intraperitoneale (ip) Injektion 2 Wochen nach der ersten MIT-Dosis und dann zweiwöchentlich verabreicht) bemerkenswert die Tumorregression (55,2 .). % Reduktion der Tumorgröße im Vergleich zu MIT allein; 74,9% Reduktion des Tumorvolumens im Vergleich zur Placebobehandlung) (Abb. 5b). ein, Anschauliches Diagramm einer präklinischen Therapie. Zwei Wochen nach subkutaner Implantation und In-vivo-Aufnahme von Geweberekombinanten erhielten männliche NOD-SCID-Mäuse entweder einzelne (mono) oder kombinierte (dual) Wirkstoffe in einem aus mehreren Zyklen bestehenden metronomischen Schema. BLI, Biolumineszenz-Bildgebung. B, Statistische Profilierung von Tumorendvolumina. PC3-Zellen wurden allein oder zusammen mit PSC27-Zellen in die Hinterflanke von Tieren xenotransplantiert. C, Vergleichende Bewertung der in-vivo-Seneszenz durch SA-β-Gal-Färbung. Die Tumoren wurden nach dem Töten der Tiere frisch seziert und als Gefrierschnitte für die histologische Färbung verarbeitet. Maßstabsbalken, 200 μm. D, Violin-Plots, die vergleichende Statistiken der SA-β-Gal-Färbung in Tumorgeweben darstellen. Und, Transcript-Assay für die in-vivo-Expression mehrerer kanonischer SASP-Faktoren in Stromazellen, die aus Tumoren isoliert wurden. Gewebe von Tieren, denen sowohl Stroma- als auch Krebszellen xenotransplantiert waren, wurden einer durch Lasereinfang-Mikrodissektion unterstützten Isolierung und anschließenden Verfahren unterzogen. Die Daten sind repräsentativ für drei biologische Replikate (n = 10 Tiere pro Gruppe). Datensätze werden als Box-and-Whisker-Plots angezeigt, in denen sich eine Box vom 25. bis zum 75. Perzentil erstreckt, wobei der Median als Linie in der Mitte angezeigt wird und die Whiskers die kleinsten und größten Werte anzeigen. F, Profiling von SASP-Transkripten in Stromazellen. Die jedem Faktor entsprechenden Signale wurden auf die der mit Vehikel behandelten Gruppe normalisiert. Notiz p16TINTE4a ist auch bekannt als CDKN2A und p21CIP1 ist auch bekannt als CDKN1A. g, Statistische Messung von Zellen mit DNA-Schäden und apoptotischen Zellen in Bioproben, die wie in beschrieben entnommen wurden ein,B. Die Werte sind als Prozentsatz der Zellen angegeben, die durch Immunhistochemie (IHC) mit Antikörpern spezifisch für Histon γH2AX oder Caspase 3 (gespalten) positiv gefärbt wurden. Für B,D-g, P Werte wurden durch zweiseitige berechnet T-Tests. h, Repräsentative IHC-Bilder von Caspase 3 (gespalten, CC3) am Ende des therapeutischen Regimes. Maßstabsbalken, 100 µm. ich, Vergleichende Überlebenszeit von Mäusen, die nach der Entwicklung von fortgeschrittenen schweren Krankheiten getötet wurden. Die Überlebensdauer wurde vom Zeitpunkt der Injektion von rekombinantem Gewebe bis zum Tod des Tieres berechnet. MS, mittleres Überleben. P Die Werte wurden durch zweiseitige Log-Rank-Tests (Mantel-Cox) berechnet. Daten in C,h sind repräsentativ für drei unabhängige Experimente. Die Daten in allen Balkendiagrammen werden als Mittelwert ± Standardabweichung angezeigt und sind repräsentativ für drei biologische Replikate. Als nächstes testeten wir, ob zelluläre Seneszenz in den Tumorherden dieser Tiere auftrat. Es überrascht nicht, dass die MIT-Verabreichung das Auftreten einer großen Anzahl von seneszenten Zellen im Tumorgewebe induziert. Die Abgabe von PCC1 an diese Chemotherapie-behandelten Tiere erschöpfte jedoch die Mehrheit der seneszenten Zellen (Abb. 5c,d). Laser-Capture-Mikrodissektion gefolgt von Transkript-Assays zeigte eine signifikant erhöhte Expression von SASP-Faktoren, einschließlich IL6, CXCL8, SPINK1, WNT16B (auch bekannt als WNT16), GM-CSF (auch bekannt als CSF2), MMP3 und IL1A, eine Tendenz, die von einer Hochregulation des Gens begleitet wird, das den Seneszenzmarker p16 . kodiertTINTE4a bei mit Chemotherapie behandelten Tieren (Abb. 5e und erweiterte Daten Abb. 6c). Diese Veränderungen wurden hauptsächlich in Stromazellen und nicht in benachbarten Krebszellen beobachtet, was die Möglichkeit einer Repopulation von restlichen Krebszellen impliziert, die häufig eine erworbene Resistenz in der behandlungsgeschädigten TME entwickeln. Nach Verabreichung von PCC1 wurden jedoch die SASP-assoziierten Veränderungen weitgehend rückgängig gemacht, wie durch Transkriptassays und RNA-seq nahegelegt (Abb. 5f und erweiterte Daten Abb. 6d). Um die der SASP-Expression zugrunde liegenden Mechanismen in MIT-behandelten Mäusen zu untersuchen, sezierten wir Tumoren von Tieren, die mit diesen beiden Mitteln 7 Tage nach der ersten Dosis der GSE-Verabreichung behandelt wurden, einem Zeitpunkt vor der Entwicklung resistenter Kolonien. Im Gegensatz zur Placebo-Behandlung erhöhte die MIT-Verabreichung DNA-Schäden und Apoptose, während die Behandlung mit PCC1 allein dies nicht tat (Abb. 5g). Wenn jedoch mit MIT behandelten Tieren gleichzeitig PCC1 verabreicht wurde, wurden DNA-Schäden und Apoptose signifikant verstärkt, was eine erhöhte Zytotoxizität bei Tieren impliziert, die sowohl Chemotherapie als auch Senolytika erhielten. Als unterstützenden Beweis beobachteten wir eine erhöhte Caspase-3-Spaltung, ein typisches Kennzeichen der zellulären Apoptose, wenn PCC1 zusammen mit MIT verabreicht wurde (Abb. 5h). Als nächstes bewerteten wir die Konsequenzen der Tumorprogression, indem wir das Überleben verschiedener Tiergruppen im Zeitverlauf verglichen. In dieser präklinischen Kohorte wurden die Tiere auf Tumorwachstum überwacht, wobei angenommen wurde, dass eine schwere Erkrankung aufgetreten ist, sobald die Tumorlast deutlich wurde (Größe ≥ 2.000 mm²).3), ein Ansatz aus früheren Studien14,49. Mäuse, die die kombinatorische MIT-PCC1-Behandlung erhielten, zeigten das längste mediane Überleben und überlebten mindestens 48,1 % länger als die Gruppe, die nur mit MIT behandelt wurde (Abb. 5i, grün gegen blau). Die alleinige Behandlung mit PCC1 verlängerte das Überleben jedoch nur geringfügig. Unsere Daten legen nahe, dass die alleinige Verabreichung von PCC1 weder das Tumorwachstum verändert noch das Überleben der Tiere fördert, während die gleichzeitige Verabreichung von PCC1 mit MIT signifikante synergistische Wirkungen hat. Bemerkenswert ist, dass die in diesen Studien durchgeführten Behandlungen von Tieren gut vertragen wurden, da keine signifikanten Störungen der Harnstoff-, Kreatinin- oder Leberenzymwerte oder des Körpergewichts beobachtet wurden (Erweiterte Daten Abb. 6e,f). Noch wichtiger ist, dass Chemotherapeutika und geroprotektive Wirkstoffe, die in in dieser Studie optimierten Dosen verabreicht wurden, die Integrität des Immunsystems oder die Gewebehomöostase kritischer Organe selbst bei immunkompetenten Mäusen nicht signifikant beeinträchtigten (Ergänzende Abb. 6a–c). Diese Ergebnisse unterstützen die Begründung, dass Anti-Aging-Mittel in Kombination mit konventioneller Chemotherapie das Potenzial haben, das Tumoransprechen zu verbessern, ohne eine schwere systemische Toxizität zu verursachen. Schon eine kleine Anzahl alternder Zellen kann bei jungen Tieren zu körperlichen Funktionsstörungen führen50. Wir fragten, ob PCC1 seneszente Zellen in vivo selektiv abtötet und dadurch körperliche Dysfunktion verhindern kann. Um diese Frage zu beantworten, führten wir eine parallele Implantation von Kontroll- und seneszenten embryonalen Fibroblasten der Maus (MEFs, 0,5 × 10 .) durch6 Zellen pro Seite), die konstitutiv Luciferase (LUC+) subkutan in syngene Wildtyp (WT)-Mäuse. Unmittelbar nach der Implantation wurden die Tiere 7 d lang mit PCC1 (20 mg pro kg über ip-Injektion) oder Vehikel (Ethanol-Polyethylenglycol 400 – Phosal 50 Propylenglycol (PG) um 10:30:60) behandelt (Abb. 6a). Wir fanden, dass die Lumineszenzsignalintensitäten bei Mäusen, denen seneszente Zellen implantiert und mit PCC1 behandelt worden waren, signifikant niedriger waren als bei mit Vehikel behandelten Wurfgeschwistern, obwohl nach der Behandlung von Mäusen, denen LUC . transplantiert wurde, kein Unterschied beobachtet wurde+ Kontrollzellen (Abb. 6b,c), was die senolytische Wirksamkeit von PCC1 in vivo belegt. ein, Schema der experimentellen Verfahren zur Zelltransplantation und physikalischen Funktionstests bei 5 Monate alten männlichen C57BL/6J-Mäusen. B, Repräsentative Bilder, die in vivo Luciferase-Aktivität 2 d nach der letzten Behandlung von Mäusen zeigen. Maßstabsleisten, 20 mm. C, Lumineszenz von transplantierten Zellen als Prozentsatz relativ zu den durchschnittlichen Signalen bei mit Vehikel behandelten Tieren. D-F, Messung der maximalen Gehgeschwindigkeit (relativ zum Ausgangswert) (D), hängende Ausdauer (Und) und Griffstärke (F) bei 5 Monate alten männlichen C57BL/6J-Mäusen, wobei die Tests 1 Monat nach der letzten Behandlung durchgeführt wurden. g, Schema des experimentellen Designs für Transplantations- und Körperfunktionsmessungen. h-J, Messung der maximalen Gehgeschwindigkeit (relativ zum Ausgangswert) (h), hängende Ausdauer (ich) und Griffstärke (J) bei 28 Wochen alten männlichen C57BL/6J-Mäusen (2 Wochen nach der letzten Behandlung). zu, Ein-Jahres-Überlebenskurven von 17 Monate alten Tieren, denen 0,5 × 10 . implantiert wurden6 Kontroll-MEF-Zellen und behandelt mit Vehikel (CTRL-Vehikel) und Mäusen, denen 0,5 × 10 . implantiert wurden6 seneszente MEF-Zellen, die entweder mit Vehikel (SEN-Vehikel) oder PCC1 (SEN-PCC1) behandelt wurden. Rote Pfeilspitzen, Zellimplantation (am 528. Lebenstag) oder das Ende der Überlebensmessung (890. Lebenstag). P Die Werte wurden durch zweiseitige Log-Rank-Tests (Mantel-Cox) berechnet. L, Vergleichende Quantifizierung von Krankheitslast (links) und Tumorlast (rechts) (dargestellt als Median mit Interquartilsabstand) nach Implantation von seneszenten Zellen und Behandlung mit Vehikel oder PCC1. m, Todesursache bei Tieren, die implantierte Zellen erhalten und mit Vehikel oder PCC1 behandelt wurden. Für D-F,h-J, werden die Daten als Box-and-Whisker-Plots angezeigt, in denen sich Boxen vom 25. Für C-F,h-J, P Werte wurden durch zweiseitige berechnet T-Tests. Anzahl Tiere, n = 5 pro Gruppe für C, n = 10 pro Gruppe für D-J, n = 27 für zu und n = 13 für L,m. NS, P > 0,05; *P < 0,05; **P < 0,01; ***P <0,001; ****P <0,0001. Als nächstes untersuchten wir, ob das Töten von implantierten seneszenten Zellen mit PCC1 pathologische Ereignisse, insbesondere körperliche Dysfunktion, abschwächen könnte. Die Behandlung von Jungtieren mit PCC1 nach der Implantation von seneszenten Zellen für 1 Woche verhinderte eine Abnahme der maximalen Gehgeschwindigkeit (RotaRod), der Hängeausdauer (Hängetest) und der Griffstärke (Griffmeter), Veränderungen, die innerhalb von 1 Monat nach der Vehikelbehandlung einer anderen Gruppe von Mäusen mit seneszente Zellen, was mit dem Potenzial von PCC1 übereinstimmt, körperliche Dysfunktion zu reduzieren (Abb. 6d–f). Die Verabreichung von PCC1 verhinderte auch die körperliche Dysfunktion, die bei Tieren 5 Wochen nach der Implantation seneszenter Zellen auftrat (Abb. 6g). Bei Mäusen, die seneszente Zellen beherbergen, verbesserte eine einzelne 5-Tage-Behandlung mit PCC1 die körperliche Funktion im Vergleich zur Vehikelbehandlung (Abb. 6 Uhr morgens - d). Bemerkenswert ist, dass die Verbesserung 2 Wochen nach der PCC1-Behandlung nachweisbar war und sogar mehrere Monate anhielt (Erweiterte Daten Abb. 7a,b). Zu diesen beiden Zeitpunkten der PCC1-Verabreichung (unmittelbar gegenüber 5 Wochen nach der Implantation seneszenter Zellen) schienen die günstigen Wirkungen von PCC1 vergleichbar zu sein. Die Daten legen nahe, dass der Zeitplan der PCC1-Verabreichung flexibel sein kann, was auf die potenzielle klinische Durchführbarkeit hindeutet. Da aus Pflanzensamen gewonnene Procyanidine normalerweise Eliminationshalbwertszeiten von <12 h . haben51,52, umgeht eine solche anhaltende Verbesserung der körperlichen Funktion nach einem einzigen Behandlungszyklus mit PCC1 die Notwendigkeit einer kontinuierlichen Behandlung mit dem senolytischen Mittel, was weiter impliziert, dass die Aktivität von PCC1 ausreicht, um eine durch seneszente Zellen induzierte körperliche Dysfunktion abzuwenden. Als nächstes versuchten wir, den Einfluss seneszenter Zellen oder den Nutzen ihrer Eliminierung bei Tieren mittleren Alters zu bewerten. Zu diesem Zweck verwendeten wir 17 Monate alte C57BL/6J-Mäuse, denen Kontroll- oder seneszente MEFs implantiert wurden. Bemerkenswert ist, dass das Überleben von Tieren, die seneszente Zellen trugen und im folgenden Jahr eine Vehikel-Behandlung erhielten, signifikant niedriger war als das von Tieren, die eine PCC1-Behandlung erhielten, mit einem 2,4-fach höheren Sterberisiko (Hazard Ratio, P = 0,0172) (Abb. 6k). Krankheitslast, Tumorlast beim Tod und Todesursachen unterschieden sich jedoch nicht signifikant zwischen den mit Vehikel behandelten Mäusen und den mit PCC1 behandelten Mäusen (Abb. 6l,m). Diese Daten legen nahe, dass eine kleine Anzahl seneszenter Zellen das Überleben durch einen allgemeinen Prozess, wie die Beschleunigung des Alterns, beeinflussen könnte, anstatt eine spezifische Pathologie oder einige individuelle Zustände zu verursachen. Die Erhöhung der seneszenten Zellbelastung führt zu einer körperlichen Dysfunktion, eine Tendenz, die mit der Sterblichkeit im mittleren Alter verbunden ist, aber durch die Gabe von Senolytika wie PCC1 verschoben werden kann. Senolytika dezimieren alternde Zellen in verschiedenen Geweben und Organen in verschiedenen pathophysiologischen Situationen, von denen die meisten mit dem Altern korreliert sind53. Um die Wirkung von PCC1 auf seneszente Zellen in Organismen und das Altern des Organismus weiter zu untersuchen, wählten wir zwei unabhängige Tiermodelle der In-vivo-Seneszenz aus, darunter therapiebeeinträchtigte Mäuse und natürlich alternde Mäuse. Zuerst induzierten wir zelluläre Seneszenz, indem wir WT-Mäuse einer Ganzkörperbestrahlung (WBI) mit einer subletalen Dosis (5 Gy) aussetzten, einem Schritt gefolgt von einer geroprotektiven Behandlung mit PCC1 (20 mg pro kg über ip Injektion) oder Vehikel (Ethanol-Polyethylen Glykol 400 – Phosal 50 PG um 10:30:60) (einmal pro Woche) (Abb. 7a). Bemerkenswert ist, dass Tiere, die sich einer WBI unterzogen hatten, ein abnormales Körperbild zeigten, einschließlich deutlich ergrauter Haare, die jedoch durch die Verabreichung von PCC1 weitgehend rückgängig gemacht wurden (Abb. 7b,c). SA-β-Gal-positive seneszente Zellen wurden bei diesen Tieren in vivo induziert, was durch eine erhöhte Färbungspositivität in Herz- und Lungengewebe belegt wurde (Abb. 7d,e). Als wir jedoch mit PCC1 durch ip-Injektion behandelten, war der Prozentsatz an SA-β-Gal-positiven Zellen in sezierten Geweben signifikant reduziert, im Gegensatz zu dem von Vehikel-behandelten Mäusen im Post-WBI-Stadium (Abb. 7f,g). Die Behandlung mit PCC1 verringerte auch die Expression von Seneszenzmarkern und einer Untergruppe der wichtigsten SASP-Faktoren im Vergleich zur Vehikelbehandlung (Abb. 7h). Zusammenfassend legen die Daten nahe, dass PCC1 SA-β-Gal-positive Zellen effektiv dezimieren, die SASP-Expression kontrollieren und die Belastung alternierender Zellen unter in-vivo-Bedingungen in Mäusen minimieren kann. ein, Schema des experimentellen Verfahrens für Mäuse, die WBI und körperliche Funktionstests erfahren. B, Ganzkörper-Schnappschuss-Vergleich von männlichen C57BL/6J-Mäusen, die naiv waren, WBI-exponiert gefolgt von einer Vehikel-Behandlung oder WBI-exponiert und mit PCC1 behandelt wurden. C, Ein Käfigbild von Tieren beschrieben in ein unter präklinischen Bedingungen. D, Repräsentative Bilder der SA-β-Gal-Färbung von Herzgewebe von unbehandelten (naiven) und WBI-behandelten Mäusen, die einer Vehikel- oder PCC1-Behandlung unterzogen wurden. Maßstabsleiste, 200 μm. Und, Repräsentative Bilder der SA-β-Gal-Färbung von Lungengewebe von Mäusen, wie in . beschrieben D. Maßstabsleiste, 200 μm. F, Vergleichende Statistik der SA-β-Gal-Färbung von Herzgewebe von untersuchten Tieren in D. g, Vergleichende Statistik der SA-β-Gal-Färbung von Lungengewebe von untersuchten Tieren in Und. h, Quantitative Messung der SASP-Expression auf Transkriptionsebene in Geweben, die von Tieren entnommen wurden, die unter den in beschriebenen Bedingungen behandelt wurden ein. ich,J, Messung der Laufstrecke auf dem Laufband (ich) und Griffstärke (J) von experimentellen Mäusen. Für F-J, P Werte wurden durch zweiseitige berechnet T-Tests. zu, Kaplan-Meier-Überlebensanalyse von C57BL/6J-Mäusen, die WBI ausgesetzt und wöchentlich mit Vehikel oder PCC1 behandelt wurden, mit naiven Mäusen als unbehandelte Kontrolle. CI, Konfidenzintervall; HR, Hazard Ratio; DFI, krankheitsfreies Intervall. P Die Werte wurden durch zweiseitige Log-Rank-Tests (Mantel-Cox) berechnet. Die Daten in Balkendiagrammen werden als Mittelwert ± SD gezeigt und sind repräsentativ für drei unabhängige Experimente. NS, P > 0,05; *P < 0,05; **P < 0,01; ***P <0,001; ****P <0,0001. Anschließend untersuchten wir die Auswirkungen präklinischer Behandlungen auf die physikalischen Parameter von Mäusen. Wie erwartet, beeinträchtigte WBI die Trainingskapazität und Muskelkraft signifikant, wie durch Laufband- und Griffkrafttests in der Fahrzeuggruppe gemessen (Abb. 7i,j). Im Gegensatz dazu bot die PCC1-Verabreichung einen erheblichen Nutzen und stellte diese Kapazitäten wieder her. Noch wichtiger ist, dass die Behandlung mit PCC1 die Überlebensrate erhöhte (Abb. 7k). Unsere Ergebnisse zeigen, dass die PCC1-induzierte Eliminierung von SA-β-Gal-positiven seneszenten Zellen eine wirksame Strategie sein könnte, um die seneszenzbedingte physikalische Regression zu lindern und die Mortalität in Situationen vorzeitiger Alterung, die durch Umweltstressoren wie zytotoxische Therapien ausgelöst wird, zu reduzieren. Als nächstes versuchten wir, den Einfluss seneszenter Zellen auf die körperliche Funktion von natürlich alternden Tieren zu definieren. Zu diesem Zweck behandelten wir normale 20 Monate alte WT-Mäuse mit Vehikel (Ethanol – Polyethylenglycol 400 – Phosal 50 PG um 10:30:60) oder PCC1 (20 mg pro kg über ip Injektion) (einmal alle 2 Wochen). 4 Monate (Abb. 8a). Die histologische Untersuchung ergab einen signifikant erhöhten Prozentsatz an SA-β-Gal-positiven seneszenten Zellen in Niere, Leber, Lunge und Prostata von gealterten Tieren, der durch eine PCC1-Behandlung rückgängig gemacht wurde (Abb. 8b, c und erweiterte Daten Abb. 8a–f). Die Ergebnisse der körperlichen Tests zeigten, dass PCC1 die körperliche Dysfunktion linderte, indem es die maximale Gehgeschwindigkeit, die Hängeausdauer, die Griffkraft, die Laufbandausdauer, die tägliche Aktivität und die Balkenbalance-Leistung von Tieren, denen PCC1 verabreicht wurde, im Vergleich zu denen, die mit Vehikel behandelt wurden, verbesserte (Abb. 8d–i), Körpergewicht und Nahrungsaufnahme blieben bei PCC1-behandelten Mäusen weitgehend unverändert (Erweiterte Daten Abb. 8g,h). Bemerkenswerterweise war die Expression des SASP in Geweben wie der Lunge von mit PCC1 behandelten gealterten Mäusen im Vergleich zu der in der mit Vehikel behandelten Gruppe signifikant reduziert (Abb. 8j), ein Muster, das mit einer geringeren Sekretion von SASP-Faktoren durch mit PCC1 behandeltes menschliches Stromagewebe übereinstimmt (Abb. 5f). einSchematisches Design für die körperliche Untersuchung von 20 Monate alten männlichen C57BL/6J-Mäusen, die 4 Monate lang einmal alle 2 Wochen (zweiwöchentlich) mit PCC1 behandelt wurden. B, Repräsentative Bilder der SA-β-Gal-Färbung von Nieren von jungen und alten Mäusen, die mit Vehikel oder PCC1 behandelt wurden. Maßstabsleiste, 200 μm. C, Quantifizierung der SA-β-Gal-Färbung wie in beschrieben B. Daten repräsentieren Mittelwert ± sd D-h, Quantifizierung der maximalen Gehgeschwindigkeit (relativ zum Ausgangswert) (D), hängende Ausdauer (Und), Griffstärke (F), Laufbandausdauer (g) und tägliche Aktivität (h) von 20 Monate alten männlichen C57BL/6J-Mäusen nach der 4-monatigen Behandlung. ich, Quantifizierung der Zeit, die benötigt wird, um den Schwebebalken zu überqueren. Datenpunkte vor und nach der Behandlung jedes Tieres werden verbunden, um einen direkten Vergleich der Behandlungseffekte zu ermöglichen. J, Quantitatives Transkript-Profiling der SASP-Expression in Lungengeweben von 6 Monate alten unbehandelten (6M), 24 Monate alten Vehikel-behandelten (24M-Vehikel) und 24 Monate alten PCC1-behandelten Mäusen (24M-PCC1) . Die Daten sind als Mittelwert ± Standardabweichung angegeben und wurden von drei biologischen Replikaten abgeleitet (n = 3 unabhängige Assays). zu, Schematisches Design für Lebensdaueranalysen von Mäusen (beide Geschlechter) im Alter von 24–27 Monaten. L,m, Überleben nach der Behandlung (L) und das Überleben des ganzen Lebens (m) Kurven von C57BL/6J-Tieren, die alle zwei Wochen mit PCC1 (n = 91; 48 Rüden, 43 Hündinnen) oder Fahrzeug (n = 80; 42 Rüden, 38 Hündinnen) im Alter von 24–27 Monaten. n, Maximale Gehgeschwindigkeit und Hängeausdauer im Durchschnitt der letzten 2 Lebensmonate (n = 10 Mäuse pro Gruppe) und Lebensdauer für die am längsten lebenden Mäuse (Top 20) in beiden Gruppen. Der, Krankheitslast und Tumorlast beim Tod. Für beide Geschlechter, n = 60 Mäuse pro Arm. Für Männer, n = 31 für PCC1 und n = 33 für Fahrzeug. Für Frauen, n = 29 für PCC1 und n = 27 für Fahrzeug. Für C-h,J, n = 3 biologisch unabhängige Assays. Die Daten werden als Box-and-Whisker-Plots angezeigt, in denen sich eine Box vom 25.D-h,n) oder als Mittelwert ± SD (Der). Ungepaarte zweischwänzige T-Tests (C-J,n,Der) und Cox-Proportional-Hazard-Regressionsmodelle (L,m) wurden verwendet, um die statistische Signifikanz zu bestimmen. Um das Potenzial der Elimination seneszenter Zellen zur Verlängerung der verbleibenden Lebensdauer von WT-Mäusen zu ermitteln, führten wir die PCC1-Behandlung ab einem sehr hohen Alter durch (Abb. 8 Tausend). Mäuse, die PCC1 (einmal alle 2 Wochen oder alle zwei Wochen) ab einem Alter von 24–27 Monaten (entspricht in etwa einem Alter von 75–90 Jahren beim Menschen) erhielten, hatten eine um 64,2 % längere mediane Lebensdauer nach der Behandlung (oder insgesamt 9,4 % länger) Lebensdauer) und geringeres Sterberisiko (65,0 %, P < 0,0001) als die mit Vehikel behandelte Gruppe (Abb. 8l,m). Diese Daten weisen darauf hin, dass PCC1 das Risiko der altersbedingten Mortalität bei alten Mäusen signifikant senken kann. Als nächstes fragten wir, ob die reduzierte Sterblichkeitsrate bei alten Tieren mit einer erhöhten Morbidität im späten Leben einherging. Wir haben die körperliche Funktion bei experimentellen Mäusen gemessen, die monatlich bis zum Tod mit PCC1 oder Vehikel behandelt wurden. Trotz der längeren Restlebensdauer bei PCC1-behandelten Mäusen war die körperliche Funktion in den letzten 2 Lebensmonaten nicht signifikant geringer als bei mit Vehikel behandelten Mäusen (Abb. 8n). Bei der Autopsie waren die Inzidenz mehrerer altersbedingter Pathologien, die Tumorbelastung und die Todesursache zwischen PCC1-behandelten und Vehikel-behandelten Mäusen nicht signifikant unterschiedlich (Abb. 8o und erweiterte Daten Abb. 9a,b). Allerdings war die Expression des SASP in soliden Organen reduziert, was weitgehend mit dem Rückgang der zirkulierenden Spiegel von Interleukin (IL)-6, Kolonie-stimulierendem Faktor (CSF)2 und Monozyten-Chemoattraktant-Protein (MCP)1 vereinbar war, repräsentative SASP-Marker im peripheren Blut (Erweiterte Daten Abb. 9c – f). Wir beobachteten auch eine verminderte Expression des SASP in CD3+ T-Zellen im peripheren Blut (Erweiterte Daten Abb. 9g), eine Zelllinie, die einen robusten Anstieg von p16 . zeigtTINTE4a Ausdruck während des menschlichen Alterns54. Darüber hinaus reduzierte die PCC1-Behandlung den oxidativen Stress im Lebergewebe, was durch eine Abnahme der Addukte des Lipidperoxidationsprodukts 4-Hydroxynonenal (HNE) und eine Zunahme des Verhältnisses von reduziertem zu oxidiertem Glutathion belegt wurde (Erweiterte Daten Abb. 9h,ich), im Einklang mit den allgemeinen Eigenschaften von Flavonoiden, die eine antioxidative Wirkung entfalten, indem sie freien Radikalen entgegenwirken und das antioxidative Abwehrsystem aktivieren55,56. Zusammenfassend lässt sich sagen, dass der senolytische Wirkstoff PCC1, eine phytochemische Komponente, die aus GSE (oder alternativ, in geringerer Menge, aus Naturprodukten wie Extrakten aus Zimt, Kakao, Apfelschalen und Kiefernrinde) gewonnen wird, die Belastung alternder und möglicherweise anderer Zellen reduzieren kann Entwicklung eines proinflammatorischen Phänotyps und von Natur aus abhängig von pro-survival-Seneszenz-assoziierten anti-apoptotischen Signalwegen und verlängert die Lebensdauer nach der Behandlung, ohne eine erhöhte Morbidität bei Mäusen zu verursachen. Wir präsentieren hiermit den Beweis des Prinzips, dass eine solche therapeutische Modalität, selbst wenn sie im späten Leben verabreicht wird, ein herausragendes Potenzial hat, altersbedingte Dysfunktionen bemerkenswert zu verzögern, altersbedingte Krankheiten zu reduzieren und den Gesundheitszustand zu verbessern, wodurch ein neuer Weg zur Verbesserung eröffnet wird Gesundheits- und Lebensspanne in der zukünftigen Geriatrie. Altern ist ein im Wesentlichen unvermeidlicher Prozess, der bei fast allen Organismen fortschreitend zu einer Verschlechterung der Funktionsfähigkeit führt. Zelluläre Seneszenz, ein Zustand des permanenten Wachstumsstillstands, hat sich in letzter Zeit sowohl als Kennzeichen als auch als Treiber des Alterns herausgestellt3,57. Seneszente Zellen sammeln sich im Laufe der Zeit in gealtertem Gewebe an und tragen zu einer zunehmenden Zahl von Pathologien bei58. Die Beseitigung seneszenter Zellen aus progeroiden oder natürlich gealterten Mäusen verlängert die Lebenserwartung, verlängert die Lebensdauer und hemmt altersbedingte Erkrankungen, einschließlich, aber nicht beschränkt auf Arteriosklerose, Osteoarthritis und neurodegenerative Erkrankungen59,60,61,62. Jüngste Fortschritte in altersbezogenen Studien führten zu einer Suche nach Medikamenten, die seneszente Zellen gezielt angreifen können, insbesondere nach einer neuen Klasse von geroprotektiven Wirkstoffen, die als Senolytika oder, weniger aggressiv, Senomorphika bezeichnet werden. Bisher wurde über eine Handvoll Senolytika berichtet, darunter Dasatinib und Quercetin, Fisetin, Piperlongumin, Hemmstoffe des Hitzeschockproteins (HSP)90 und Inhibitoren der BCL-2-Familie wie ABT-263 (Navitoclax) und ABT-737 (Ref. 11,12,13,18,19,21,22). Unter ihnen sind BCL-2-Hemmer die am häufigsten verwendeten Senolytika, obwohl sie ursprünglich als Therapien für Lymphome entwickelt wurden. ABT-737 zielt auf BCL-2, BCL-xL und BCL-w ab, jedoch mit geringer Löslichkeit und oraler Bioverfügbarkeit. Wirksamer für die in vivo-Anwendung, hemmt ABT-263 hauptsächlich BCL-2 und BCL-xL, während es häufig Thrombozytopenie verursacht. Angesichts der ausgeprägten Nebenwirkungen einiger senolytischer Verbindungen besteht die Notwendigkeit, neue Verbindungen mit senolytischer Aktivität, aber verringerter Zytotoxizität zu identifizieren. In dieser Studie haben wir eine PDMA-basierte Medikamentenbibliothek gescreent, die hauptsächlich aus Naturstoffen besteht, mit dem Ziel, neue Wirkstoffe zu identifizieren, die seneszente Zellen mit optimaler Wirksamkeit und Sicherheit in vivo angreifen können. Als Ergebnis identifizierten wir PCC1, einen aus natürlichen Quellen gewonnenen phytochemischen Wirkstoff, als eine senolytische Breitbandverbindung. Als besonderer Vorteil, PCC1 kann alternativ als senomorphes Mittel wirken, um die SASP-Expression zu minimieren, wenn es in niedrigen Konzentrationen verwendet wird. Ein solches vorteilhaftes Merkmal von PCC1 ähnelt in der Tat weitgehend dem von GSE, das sowohl senomorphe als auch senolytische Wirkungen erzeugen kann. Genetische und pharmakologische Strategien zeigten eine Reihe von Vorteilen der Eliminierung alternder Zellen, um das Altern zu verzögern und Krankheiten zu kontrollieren. Die zelluläre Seneszenz kann durch eine Vielzahl von Stimuli ausgelöst werden, die von onkogener Aktivierung, genotoxischem Stress bis hin zu Entzündungsreaktionen und replikativer Erschöpfung reichen. Mehrere Verbindungen werden als Breitspektrum-Senolytika identifiziert, während andere nur gegen eine bestimmte Art von seneszenten Zellen selektiv sind. Unterschiede in der Spezifität implizieren eine individuelle Auswahl von Senolytika, die hauptsächlich von der beabsichtigten klinischen Anwendung abhängen. Eine kürzlich durchgeführte Studie ergab, dass Ouabain, eine natürliche Verbindung aus der Familie der Herzglykoside, als senolytisches Mittel verwendet werden kann, das sowohl für die Eliminierung alternder Zellen als auch für die Krebstherapie verwendet werden kann, wobei letztere durch einen dualen Wirkmechanismus umgesetzt wird63. In dieser Arbeit entdeckten wir PCC1 als ein weiteres neues, natürliches und potentes Senolytikum, das selektiv und spezifisch die Apoptose von seneszenten Zellen induziert, jedoch mit begrenzter Zytotoxizität gegenüber proliferierenden Zellen64. Bemerkenswert ist, dass PCC1 in niedrigeren Konzentrationen die SASP-Expression hemmt, eine Eigenschaft, die von einigen pflanzlichen Flavonoiden wie Apigenin und Kaempferol geteilt wird, die als Senomorphe wirken können, um den Einfluss alternder Zellen auf altersbedingte Erkrankungen zu begrenzen65,66. Obwohl nur wenige Studien einen so zweifachen Mechanismus natürlicher Wirkstoffe beim Targeting seneszenter Zellen offenbart haben, hat das kürzlich synthetisierte Quercetin oberflächenfunktionalisierte Fe3DAS4 Nanopartikel zeigten in menschlichen Fibroblasten sowohl ein senolytisches als auch ein senomorphes Potenzial, indem sie die Aktivität der AMP-aktivierten Proteinkinase (AMPK) steigerten67. Der Mechanismus, durch den PCC1 senolytische Wirkungen erzielt, erscheint komplex und erfordert weitere Untersuchungen. Unsere Daten deuten darauf hin, dass PCC1 die funktionelle Integrität von Mitochondrien beeinträchtigt, Δψm kompromittiert, zu einer erhöhten Produktion von freien Radikalen wie ROS führt und die Freisetzung von Cytochrom c in seneszenten Zellen, jedoch nicht in proliferierenden Zellen, verursacht. Ein möglicher Grund für diese Spezifität ist, dass seneszente Zellen dazu neigen, eine depolarisierte Plasmamembran zu entwickeln und erhöhte H .-Konzentrationen aufweisen+ (Bez. 64), ein Merkmal, das sie anfälliger für die Wirkung von PCC1 machen könnte. Bemerkenswert ist, dass diese Veränderungen von einer hochregulierten Expression pro-apoptotischer Faktoren, insbesondere von NOXA und PUMA, begleitet werden, Ereignisse, die auch die Apoptose seneszenter Zellen entscheidend fördern. Innerhalb der Familie der Procyanidine, von denen bekannt ist, dass sie aus der Polymerisation von Flavan-3-ol-Molekülen stammen und als Oligomere oder Polymere vorkommen28, PCC1 scheint funktionell einzigartig zu sein. Unsere experimentellen Daten deuten auf einen merklichen Unterschied zwischen PCC1 (einem Trimer) und anderen Procyanidinen (von denen die meisten tatsächlich Monomere oder Dimere wie PCB2) sind. Da wir die Mitglieder der Procyanidin-Familie nicht umfassend untersucht haben, bleibt eine offene, aber faszinierende Frage, ob die Anzahl der Monomere im Molekül sein Antiseneszenz-Potenzial bestimmt, und die zugrunde liegenden Mechanismen verdienen weitere Studien in der Zukunft. Die zelluläre Seneszenz an sich ist ein sehr heterogener Prozess, der von unterschiedlichen Zellherkünften und Umweltreizen abhängt68. Eines der Hauptmerkmale von PCC1 ist seine Fähigkeit, seneszente Zellen in einem breiten Spektrum von Zelltypen und Stressoren, einschließlich Replikation, Onkogene, Bestrahlung und Chemotherapie, effizient zu beseitigen. In dieser Studie verglichen wir PCC1 mit anderen berichteten Senolytika im Hinblick auf Wirkungen auf menschliche Stromazellen, Fibroblasten, HUVECs und MSCs, die wichtigsten Zelltypen in der Gewebemikroumgebung. Wie berichtet, eliminiert ABT-263 seneszente humane embryonale Fibroblasten (HEFs) und HUVECs, hat aber nur geringe Wirkung auf humane Präadipozyten12,18. Die kombinierte Anwendung von Dasatinib und Quercetin kann dosisabhängig alle drei Arten alternder Zellen dezimieren, ist jedoch für proliferierende Zellen toxisch11,69,70. Fisetin, ein weiteres natürliches Flavonoid, das als senolytischer Wirkstoff beschrieben wurde, zeigt nur bei hohen Konzentrationen mäßige Wirkungen auf alternde HEFs und Präadipozyten.20,21. Im Gegensatz dazu hat PCC1 das Potenzial, diese Einschränkungen zu überwinden, einschließlich der Zelltypabhängigkeit, der hohen Toxizität bei nicht seneszenten Zellen und der geringen Wirksamkeit gegenüber seneszenten Zellen. Obwohl Quercetin (ein anderes Flavonoid bei GSE) bei alleiniger Anwendung per se Zytotoxizität gegenüber seneszenten Stromazellen zeigte, ist seine Wirksamkeit im Allgemeinen geringer als die von PCC1 (vgl. 2a,c und ergänzende Abb. 3n und 4n). Zusammen hat PCC1 eine überlegene senolytische Aktivität mit hoher Spezifität und Effizienz für ein breiteres Spektrum von Zelltypen als viele berichtete Senolytika wie ABT-263, Dasatinib, Quercetin und Fisetin und kann auf seneszente Zellen abzielen, die von mehreren Haupttypen von Seneszenzinduktoren erzeugt werden. Wir fanden heraus, dass PCC1 unter In-vivo-Bedingungen eine Apoptose-induzierende Wirkung auf seneszente Zellen ausübt. PCC1 eliminierte effektiv therapieinduzierte seneszente Zellen und reduzierte Seneszenzmarker in festen Organen, was seine Wirksamkeit in vivo unterstreicht. In dieser Studie haben wir auch natürlich gealterte Mäuse mit PCC1 behandelt und seine Wirkung auf seneszente Zellen, chronische Entzündungen und körperliche Funktion getestet. Erstens erschöpfte die PCC1-Behandlung seneszente Zellen in mehreren Geweben und verringerte die SASP-assoziierten Signaturen, wie durch die GSEA-Analyse gezeigt. Zweitens könnte PCC1 die Expression von SASP-assoziierten Genen in gealterten Lebern und Nieren unterdrücken und chronische, geringgradige Entzündungen im Blut reduzieren. Drittens linderte PCC1 beeinträchtigte motorische Funktion, Gleichgewicht, erschöpfte Bewegung, Muskelkraft und spontane Exploration bei alten Mäusen. Am wichtigsten, Die Leistung bei RotaRod- und Balkenwaage-Tests in der PCC1-behandelten Gruppe war im Vergleich zu der unter der anfänglichen Vorbehandlungsbedingung verbessert. Insgesamt zielt die phytochemische Verbindung PCC1 selektiv auf seneszente Zellen in der Mikroumgebung des Gewebes ab und erzeugt bemerkenswerte biologische Wirkungen bei natürlich gealterten Mäusen. Ähnlich wie chemisch synthetisierte Gegenstücke zeigen natürlich abgeleitete Procyanidine entzündungshemmende, antiarthritische, antiallergische und krebsbekämpfende Wirkungen, fangen sauerstofffreie Radikale ab und unterdrücken die strahlungsinduzierte Peroxidationsaktivität36,71. Als Epicatechin-Trimer, das aus Pflanzenmaterial, vor allem aus Traubenkernen, isoliert wird, hat PCC1 nachweislich gesundheitliche Vorteile bei chronischen pathologischen Zuständen72. Eine gründliche Bewertung der toxikologischen Wirkungen von PCC1 in vivo ist jedoch für eine potenzielle klinische Anwendung von entscheidender Bedeutung. Unsere Daten zeigten, dass hochkonzentrierte (20 mg pro kg) und hochfrequente PCC1-Behandlung (zweiwöchentlich) keine offensichtlichen systemischen Toxizitäten aufwiesen. Zusammenfassend zeigt unsere Studie die Überlegenheit und relative Sicherheit einer geroprotektiven Strategie, die selektiv auf alternde Zellen in gealterten oder behandlungsgeschädigten Geweben über ein breites Spektrum von Zelltypen abzielt. Es ist jedoch möglich, dass die PCC1-Konzentrationen in vivo zwischen den Organen variieren und von der verabreichten Dosis, Pharmakodynamik und Pharmakokinetik abhängen und dass die lokalen Konzentrationen nicht hoch genug sind, um in einigen Gewebetypen eine senolytische Wirkung zu erzielen. In diesem Fall, Insgesamt eröffnet unsere Studie einen neuen Weg zur Verlängerung der Gesundheits- und Lebenserwartung sowie zur Behandlung altersbedingter Pathologien mit einem senotherapeutischen Mittel (mit sowohl senomorphem als auch senolytischem Potenzial), das aus natürlichen Quellen gewonnen wird und eine ausgeprägte Wirksamkeit besitzt. Die potenzielle Anti-Aging-Wirkung von PCC1, die in unseren präklinischen Assays nachgewiesen wurde, bietet eine gute Unterstützung für die weitere translationale und klinische Entwicklung von PCC1 mit dem übergeordneten Ziel, ein längeres und gesünderes Leben zu erreichen.Hauptsächlich
Ergebnisse
Niedrige Konzentrationen von GSE hemmen die SASP-Expression
GSE hat in hohen Konzentrationen senolytische Aktivität
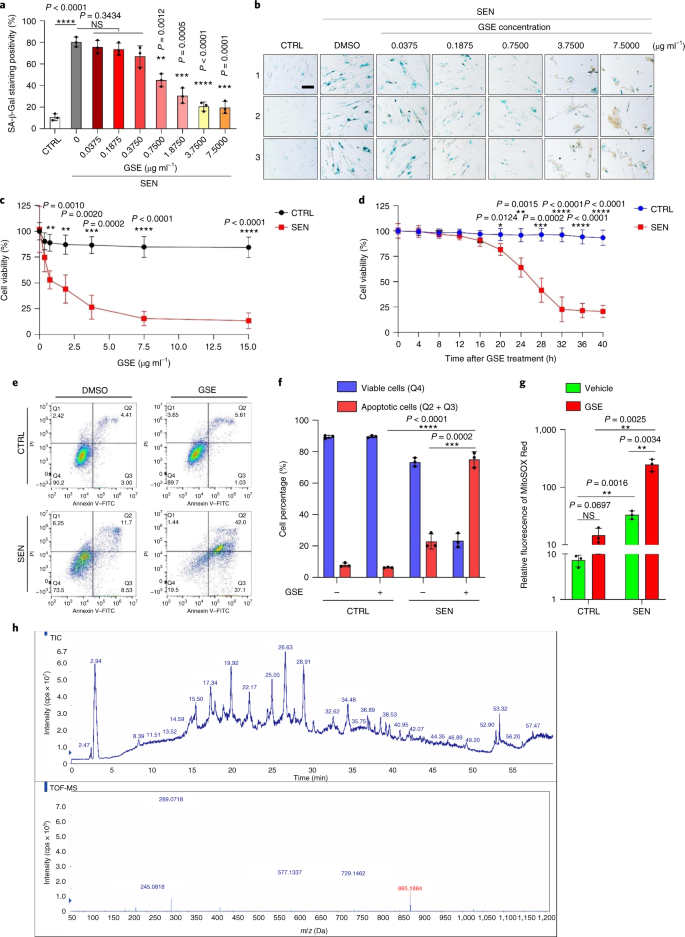
Die PCC1-Komponente von GSE hat senolytische Aktivität
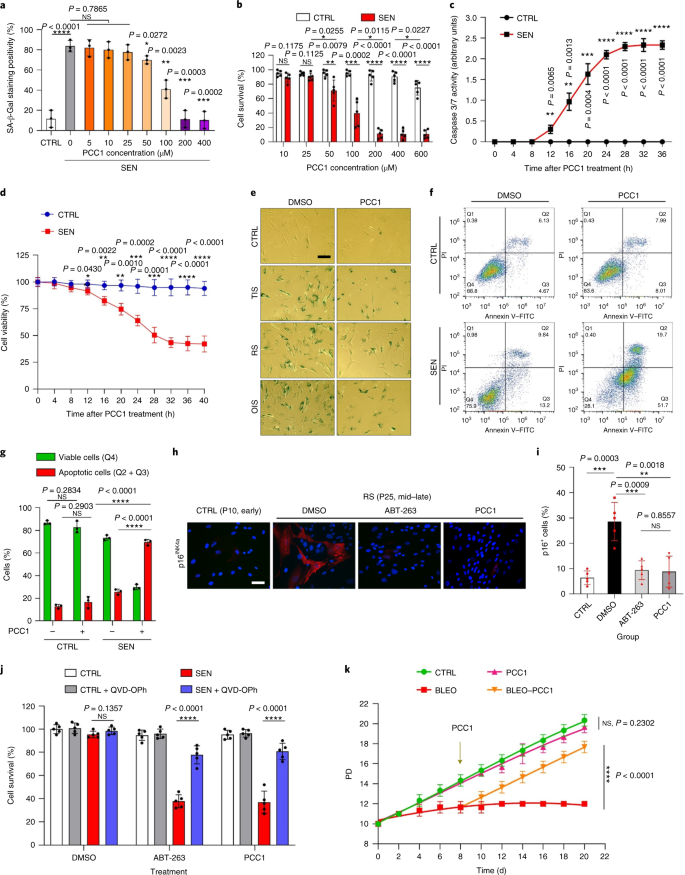
PCC1 induziert mitochondriale Dysfunktion in seneszenten Zellen
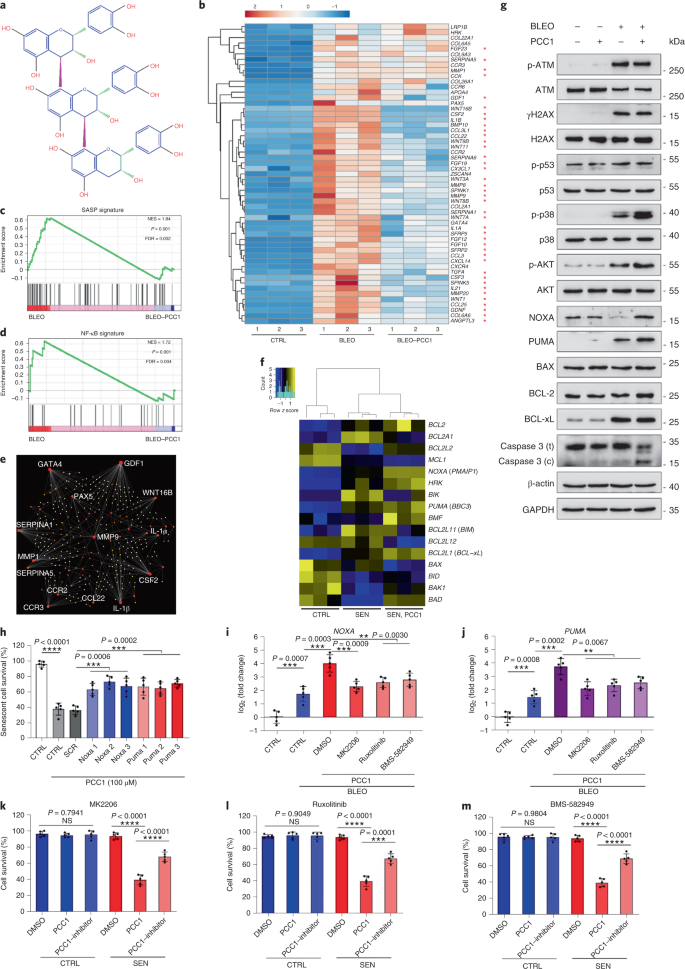
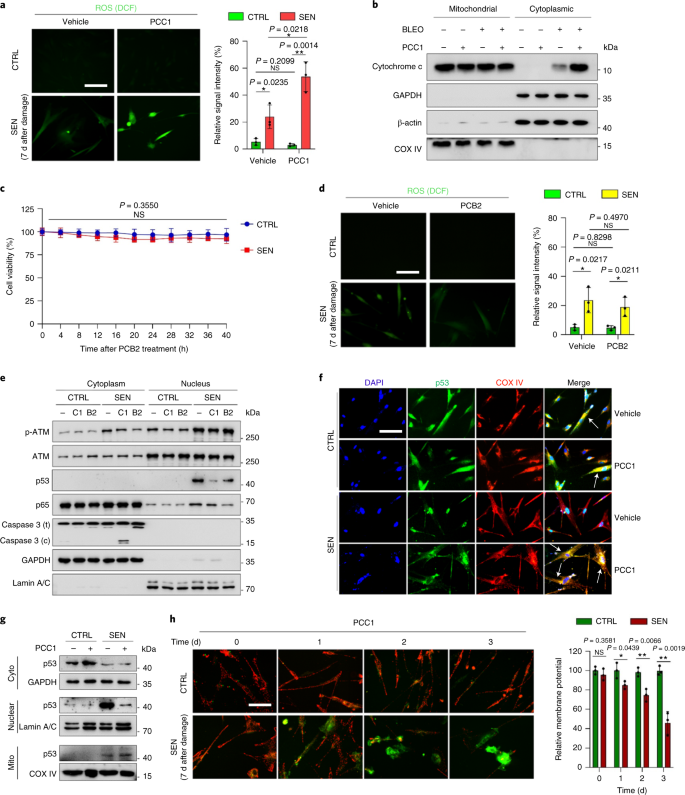
PCC1 fördert die Tumorregression und reduziert die Chemoresistenz

Die Entfernung alternder Zellen als Ergebnis der PCC1-Behandlung lindert körperliche Dysfunktion
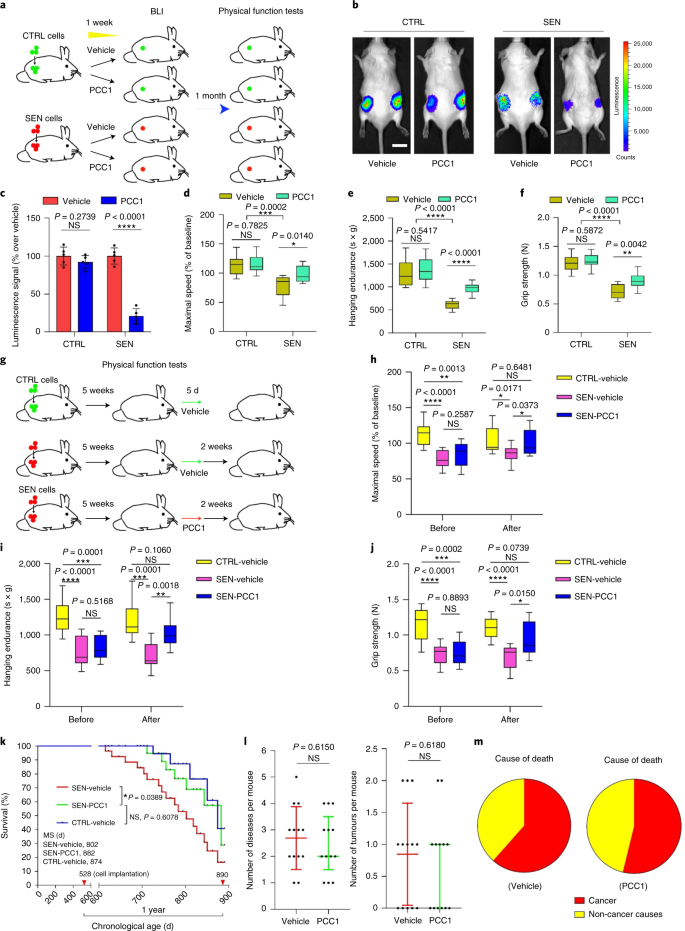
PCC1 erhält die körperliche Funktion und verlängert das Überleben von gealterten Mäusen
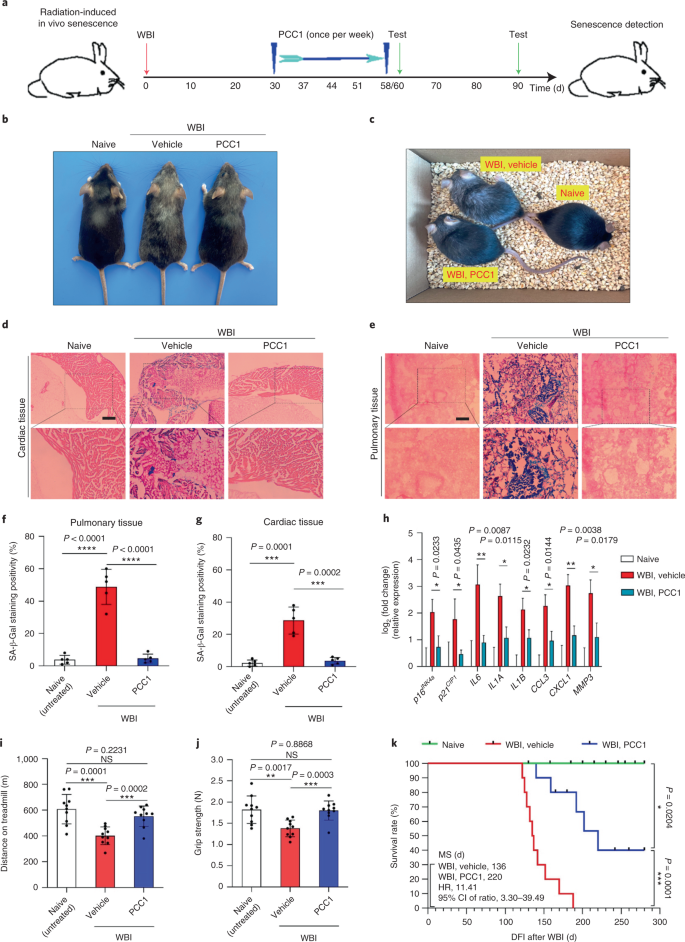
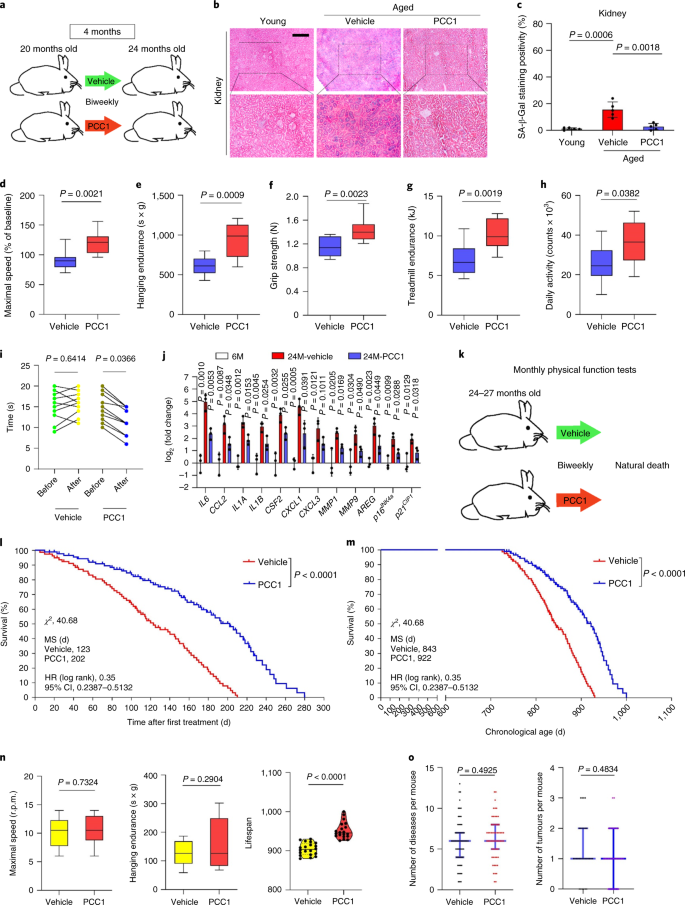
Diskussion




